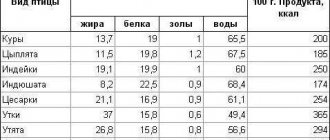
Натрий (Na, Natrium) – вещество, с которым мы имеем дело каждый день. Кладя в выпечку соду для пышности или подсаливая суп для вкуса, вы даже не задумываетесь о том, что пополняете, таким образом, запасы натрия в своем организме.
- Продукты, в которых содержится натрий
- Зачем нужен натрий в соли?
- Недостаток натрия в организме человека
- Чем нам грозит избыток натрия?
- Суточная норма натрия
- Функции натрия в организме человека
Как и многие другие микроэлементы, этот люди начали использовать задолго до его официального открытия. Так древние египтяне обнаружили в озерах соду, которую они называли «натрон», и нашли ей широчайший спектр применения в быту.
С помощью данного соединения натрия египтяне отбеливали холсты, готовили художественные краски и глазурь, варили еду, мыли тело и даже бальзамировали усопших – делали из них своих известных на весь мир мумий. Но не только жители Древнего Египта могли похвастаться таким активным применением соды. Арабы, греки и римляне того времени также использовали ее для подобных целей.
Сам термин «натрий» произошел от латинского слова «natrium», которое, в свою очередь, было заимствовано из египетского языка и значило в нем «едкий натр», «сода».
Открытие чистого натрия принадлежит англичанину Хемфри Дэви, который в начале XIX века выделил сначала калий, а затем и интересующее нас вещество с помощью электролиза расплава гидроксида натрия.
В виде соединений этот минерал содержится в морской воде и земной коре, но нас, конечно же, интересуют более доступные источники натрия. Речь идет о пище. Итак, какие продукты содержат натрий?
К содержанию
Как появилось название “натрий”
Натрий, Natrium, Na (11)
Название натрий — sodium, natrium происходит от древнего слова, распространенного в Египте, у древних греков (vixpov) и римлян. Оно встречается у Плиния (Nitron), у других древних авторов и соответствует древнееврейскому нетер (neter). В древнем Египте натроном, или нитроном, называли вообще щелочь, получаемую не только из природных содовых озер, но и из золы растений. Ее употребляли для мытья, изготовления глазурей, при мумификации трупов. В средние века название нитрон (nitron, natron, nataron), а также борах (baurach), относилось и к селитре (Nitrum). Арабские алхимики называли щелочи alkali. С открытием пороха в Европе селитру (Sal Petrae) стали строго отличать от щелочей, и в XVII в. уже различали нелетучие, или фиксированные щелочи, и летучую щелочь (Alkali volatile). Вместе с тем было установлено различие между растительной (Alkali fixum vegetabile — поташ) и минеральной щелочью (Alkali fixum minerale — сода).
В конце XVIII в. Клапрот ввел для минеральной щелочи название натрон (Natron), или натр и для растительной — кали (Kali), Лавуазье не поместил щелочи в «Таблицу простых тел», указав в примечании к ней, что это, вероятно, сложные вещества, которые когда-нибудь будут разложены. Действительно, в 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы — калий и натрий, назвав их потассий (Potassium) и содий (Sodium). В следующем году Гильберт, издатель известных «Анналов физики», предложил именовать новые металлы калием и натронием (Natronium); Берцелиус сократил последнее название до «натрий» (Natrium). В начале XIX в. в России натрий называли содием (Двигубский, 182i; Соловьев, 1824); Страхов предлагал название содь (1825). Соли натрия назывались, например, сернокислая сода, гидрохлоровая сода и одновременно уксусный натр (Двигубский, 1828). Гесс, по примеру Берцелиуса, ввел название натрий.
Пища, от которой желательно воздержаться
Некоторые продукты содержат очень большое количество соли, и их употребление желательно ограничить. К ним относятся:
- все колбасные изделия, буженина, ветчина;
- маринованные, консервированные овощи и соленья;
- соусы – майонез, кетчуп, соевый уксус;
- сыр;
- соленая и вяленая рыба;
- сухарики и орешки с солью, чипсы;
- пищевая сода и кондитерские продукты с ее добавлением.

История и происхождение названия
Натрий (а точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречающаяся в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
Название «натрий» (natrium) происходит от арабского натрун по-гречески — nitron и первоначально оно относилось к природной соде. Сам элемент ранее именовался содием Sodium.
Вывод редакции.
Думается, что нас ожидают новые исследования этой области в ближайшем будущем.
Ни так давно жиры были основной проблемой человечества, теперь же « кричат» что жиры «добро», а вот углеводы «зло». Просто кому-то нужно провести исследования, кому-то — пропиариться, еще кому-то, на этом заработать. Вот и все.
На самом деле, существенных изменений не произошло. Основной вред в жирах, как исходил от трансжиров, так и исходит. Сами же жиры, как и углеводы и белки, а так же все минеральные вещества, необходимы нашему организму.
Мы, очередной раз, хотим донести до наших читателей, что всего должно быть в меру. Не переедайте и следите за тем, что едите.
, за сегодня 1
Получение
Первым способом получения натрия стала реакция восстановления карбоната натрия
углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000°C:
Na2CO3+2C=2Na+3CO
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия.
Технологии получения
- Рутений извлекают из платиновой либо никелево-медной руды. Причем делают это, когда сырье «очищено» от других ценных элементов. То есть основной источник металла – отходы, оставшиеся в результате очистки платины или металлов ее группы.Полный цикл (включая обогащение руды и термохимическое воздействие), занимает полтора месяца.
- Второй источник – содержимое отработанных ТВЭЛов, отходы ядерного производства. Материалом служат уран, торий, плутоний. Тонна продукта радиоактивного распада содержит до 250 граммов рутения.
- Третий – изотоп технеция, облученный потоком нейтронов.
Минералы, месторождения
В природе встречаются минералы:
- мирабилит (глауберова соль);
- галит (каменная соль);
- бура (формула Na2В4О7 • 10Н2О);
- криолит.

Месторождений металлического натрия на планете нет. В любом месте (даже в пустынях) найдется вода, с которой металл мгновенно прореагирует.
Добыча и переработка
Для производства натрия ведется добыча минералов во многих странах:
- Россия;
- США;
- Германия;
- Мексика;
- Италия.
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Основной способ промышленного получения натрия — электролиз NaOH или NaCl.
Возможно получение с помощью термического разложения NaN3.

Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», спектральный дублет 588,9950 и 589,5924 нм
Химические свойства
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина
. Натрий менее активный чем
литий
, поэтому с
азотом
реагирует только при нагревании:
2Na + 3N2=2NaN3
При большом избытке кислорода образуется пероксид натрия
2Na + O2 = Na2O2
Окисление и горение
Теперь можно перейти к химическим свойствам натрия (Na). Этот щелочной металл, находясь на воздухе, легко окисляется. В итоге образуется оксид натрия (Na2O). Выглядит он как бесцветные кубические кристаллы. Это солеобразующее бинарное неорганическое вещество, которое применяется как реактив в процессе синтеза. С его помощью изготавливают гидроксид натрия и прочие соединения.
Поэтому, чтобы защитить металл от кислородного воздействия, его хранят в керосине.
А вот при горении образуется пероксид натрия (Na2O2). Они выглядят как бело-желтые кристаллы, для которых характерно энергичное взаимодействие с водой, сопровождающееся выделением тепла. Na2O2 применяют для отбеливания шелка, шерсти, тканей, соломы, вискозной и древесной массы.
Реакции с водой
С H2O серебристо-белый мягкий металл натрий также успешно взаимодействует. Реакция с водой получается очень бурной. Небольшой кусочек натрия, помещенный в эту жидкость, всплывает, и из-за выделяющегося тепла начинает плавиться. В итоге он превращается в белый шарик, который в быстром темпе движется по поверхности воды в разных направлениях.
Эта весьма эффектная реакция сопровождается выделением водорода. Проводя подобный эксперимент, нужно проявлять осторожность, так как он может воспламениться. А происходит все по следующему уравнению: 2Na + 2Н2О → 2NaOH + Н2↑.

Взаимодействия с неметаллами
Натрий – это металл, его еще можно назвать сильным восстановителем, которым он и является. Как и другие щелочные вещества, впрочем. Так что он энергично взаимодействует со многими неметаллами, кроме углерода, йода и благородных газов, к которым относится радиоактивный радон, криптон, неон, ксенон, аргон и гелий. Такие реакции выглядят так: 2Na + Cl2 → 2NaCl. Или вот еще пример: 2Na + Н2 → 250-450 °С 2NaH.
Стоит отметить, что натрий является более активным, чем литий. В принципе, он может реагировать с азотом, но очень плохо (в тлеющем разряде). В итоге этого взаимодействия образуется неустойчивое вещество, называющееся нитридом натрия. Это кристаллы темно-серого цвета, реагирующие с водой и разлагающиеся при нагревании. Образуются они по уравнению: 6Na + N2 → 2Na3N.

Реакции с кислотами
Их тоже следует перечислить, рассказывая про химические характеристики натрия. С разбавленными кислотами данное вещество взаимодействует, как обычный металл. Выглядит это так: 2Na + 2HCl → 2NaCl + Н2↑.
С концентрированными веществами, которым свойственны окислительные реакции, натрий взаимодействует иначе, такие реакции сопровождаются выделением продуктов восстановления. Вот пример формулы: 8Na + 10NHO3 → 8NaNO3 + 3Н2О.
Еще стоит отметить, что щелочной металл натрий легко растворяется в жидком аммиаке (NH3), 10-процентный раствор которого прекрасно всем известен, как нашатырь. Уравнение выглядит так: Na + 4NH3 → -40°С Na [NH3]4. Вследствие этой реакции образуется синий раствор.
С газообразным аммиаком металл также взаимодействует, но при нагревании. Выглядит данная реакция так: 2Na + 2NH3 → 350°С2NaNH2 + Н2.

Другие соединения
Перечисляя основные свойства натрия, стоит также оговориться, что он может взаимодействовать со ртутью – уникальным элементом, который при нормальных условиях представляет собой бело-серебристую тяжелую жидкость, являясь при этом металлом.
В результате такой реакции образуется сплав. Его точное название – амальгама натрия. Используется это вещество как восстановитель, по своим свойствам являющийся мягче чистого металла. Если подвергнуть его тепловой обработке вместе с калием, то получится жидкий сплав.
А еще этот металл может растворяться в так называемых краун-эфирах – макрогетероциклических соединениях, но только в присутствии растворителей органического происхождения. В результате данной реакции образуется алкалид (соль, сильный восстановитель) или электрид (растворитель синего цвета).
Также нельзя не упомянуть, что алкилгалогениды, являющиеся галогенно-углеродными веществами, с избытком натрия дают натрийорганические соединения. На воздухе они обычно самовоспламеняются. А в воде – взрываются.

Применение
Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием
используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %,
калий
47 %,
цезий
41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12-24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом,
добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна)
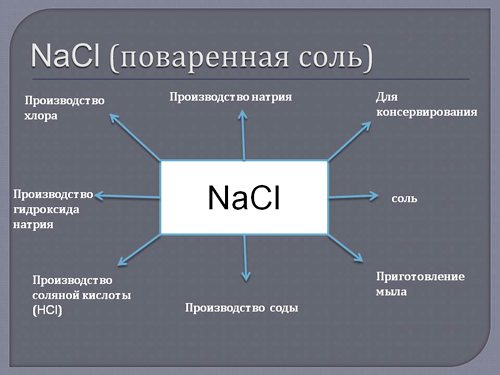
— Хлорид натрия (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство. — Азид натрия (Na3N) применяется в качестве азотирующего средства в металлургии и при получении азида свинца. — Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение). — Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Промышленность
Главный потребитель металла.
Его забирают следующие отрасли:
- Производство электроники.
- Электрохимия.
- Химическое производство.
Эти направления используют 90% сырья.
Химики ценят металл за инертность и свойства катализатора:
- Он наделен уникальным свойством избирательности в реакциях. За это востребован при синтезировании органических и неорганических веществ.
- В паре с ним каталитическая активность платины повышается.
- Рутениевые соединения используются как суперокислители, пигменты в составе стекла, эмалей.
Без рутения как элемента сплавов не обходятся передовые отрасли:
- Из них делают узлы, контакты приборов повышенной точности для нужд радио-, электро-, аэрокосмической техники, оборонного комплекса. Для этого достаточно 1,1-4,9% рутения в сплаве.
- 0,1% рутения, добавленная к титану, кратно повышает антикоррозионные свойства последнего.
- Рутениево-платиновый симбиоз – материал для изготовления топливных систем, систем по очистке воды на космических кораблях.
- Тугоплавкий металл добавляют в сплавы при изготовлении приборов, замеряющих сверхвысокие температуры.
Чистым рутением покрывают особо важные детали, чтобы сделать их устойчивее механически, химически.
Ювелирное дело
- В ювелирных изделиях применение металла двояко: как укрепляющего компонента сплава и прочного покрытия.
- Изделия из сплавов с рутениевой лигатурой надежны, прочны, что важно для украшений, испытывающих повышенные нагрузки (кольца, перстни, браслеты).
- Покрытие рутением создает на поверхности изделия пленку в гамме оттенков от графита до черноты.
Вместе с родием они создают элитарное чёрное золото.
Чем интересен для ученых
Рутений околдовывал многие поколения ученых. Выяснилось, что некоторые его характеристики почти копируют платиноиды родий и осмий, другие – железо.
Но и через почти двести лет после открытия элемента вопросы остаются:
- Главное препятствие создает валентность. У рутения она восьми видов. Это не самое «страшное». Во время опытов валентность спонтанно, неожиданно меняется.
- Нестандартны каталитические возможности. Ручаться за исход процесса сложно: металл сам «решает», какому элементу помогать ускоряться, какому нет.
Поэтому не удается пока получить стойкий чистый металл.
Эти обстоятельства только раззадоривают ученых, особенно молодежь. Они намерены приручить своенравный металл. Особо привлекательные направления – полное и экономически оптимальное извлечение элемента из минералов, шлама, ядерных отходов.
Как и платина, нанодозы рутения присутствуют в тканях биологических организмов (у человека это мышцы).
Металл, его соединения биологически активны. Данное свойство используют дерматологи, онкологи, фтизиатры.
На особом счету неорганический краситель, известный как «рутениевый красный». Он контрастно выделяет ткани, другие биологические субстанции, исследуемые под микроскопом.
Однако есть опасные для человека соединения:
- Диоксид. Весьма ядовит, вызывает рвоту, приступы удушья. Провоцирует аллергию, язвы на слизистых оболочках.
- Четырехвалентная окись. Воздействия органики (например, спирта) или нагрева выше 100°С достаточно, чтобы прогремел взрыв.
Это нужно учитывать, если в семье есть поклонники домашних химических опытов. Такие субстанции хранят в специальных емкостях.
Биологическое значение хлорида натрия или соли
Кристалл поваренной соли, имеющий ионную химическую связь, необходим для полноценной жизни и деятельности человека, иных живых организмов. Хлорид натрия принимает участие в регулировании и поддержании водно-солевого баланса, щелочного обмена. Биологические механизмы контролируют постоянство концентрации хлористого натрия в различных жидкостях, например, в крови.
Разность концентраций NaCl внутри клетки и снаружи – основной механизм для попадания внутрь питательных веществ, а также вывода продуктов жизнедеятельности. Аналогичный процесс применяется в генерации и передаче нейронами импульсов. Также анион хлора в данном соединении – основной материл для образования соляной кислоты, важнейшего компонента желудочного сока.
Дневная потребность в этом веществе составляет от 1,5 до 4 граммов, а для жаркого климата доза хлорида натрия возрастает в несколько раз.
Организм нуждается не в самом соединении, а в катионе Na+ и анионе Cl-. При недостаточном количестве этих ионов происходит разрушение мышечной и костной тканей. Появляются депрессии, психические и нервные заболевания, нарушения в деятельности сердечно-сосудистой системы и процессах пищеварения, спазмы мускулатуры, анорексия, остеопороз.
Хроническая нехватка ионов Na+ и Cl- приводит к смерти. Биохимик Жорес Медведев отмечал, что при полном отсутствии в организме соли можно продержаться не больше 11 суток.
Племена скотоводов и охотников еще в древности для удовлетворения потребности организма в соли, употребляли в сыром виде мясопродукты. Земледельческие племена потребляли растительную пищу, в которой незначительное количество хлористого натрия. В качестве признаков, сигнализирующих о нехватке соли, выделяют слабость и головную боль, тошноту, головокружение.

Особенности производства
В далеком прошлом добыча соли осуществлялась путем сжигания в кострах определенных растений. Образующуюся золу применяли в виде приправы.
Очистка поваренной соли, полученной путем выпаривания морской воды, не проводилась, полученное вещество сразу же употреблялось в пищу. Такая технология возникла в странах с жарким и сухим климатом, где подобный процесс происходил без вмешательства человека, а затем, когда его переняли иные страны, морская вода стала подогреваться искусственным путем.
На берегах Белого моря строились солеварни, в которых путем выпаривания и замораживания получали концентрированный рассол и пресную воду.

Природные месторождения
Среди мест, характеризующихся большими запасами поваренной соли, выделим:
- Артемовское месторождение, расположенное в Донецкой области. Здесь осуществляется добыча соли шахтовым способом;
- озеро Баскунчак, перевоз ведется по специально построенной железной дороге;
- калийные соли в большом количестве обнаружены в Верхнекамском месторождении, где шахтовым способом идет добыча этого полезного ископаемого;
- в Одесских лиманах велась добыча до 1931 года, в настоящее время месторождение не используется в промышленных объемах;
- в Сереговском месторождении проводится выпаривание рапы.
Соляная шахта
Биологические свойства поваренной соли сделали ее важным экономическим объектом. На 2006 год на российском рынке использовалось порядка 4,5 миллионов тонн данного минерала, причем 0,56 млн тонн шло на пищевые расходы, а оставшиеся 4 миллиона тонн уходили на нужды химической промышленности.

Физические характеристики
Рассмотрим некоторые свойства поваренной соли. Данное вещество достаточно хорошо растворяется в воде, причем на процесс влияет несколько факторов:
- температура;
- наличие примесей.
Кристалл поваренной соли содержит примеси в виде катионов кальция, магния. Именно поэтому хлорид натрия впитывает воду (сыреет на воздухе). Если такие ионы не входят в состав поваренной соли, такое свойство отсутствует.
Температура плавления поваренной соли – 800,8 °С, что свидетельствует о прочной кристаллической структуры данного соединения. При смешивании мелкого порошка хлорида натрия с измельченным льдом получают охладитель высокого качества.
Например, 100 г льда и 30 г поваренной соли могут снижать температуру до −20 °C. Причина подобного явления в том, что раствор поваренной соли замерзает при температуре ниже 0 °C. Лед, для которого это значение является температурой плавления, плавится в подобном растворе, поглощая тепло окружающей среды.
Высокая температура плавления поваренной соли объясняет ее термодинамические характеристики, а также высокую диэлектрическую проницаемость – 6,3.

Получение
Учитывая, насколько важны биологические и химические свойства поваренной соли, ее существенные природные запасы, нет необходимости разрабатывать вариант промышленного производства данного вещества. Остановимся на лабораторных вариантах получения хлорида натрия:
- Данное соединение можно получить в качестве продукта при взаимодействии сульфата меди (2) с хлоридом бария. После удаления осадка, в качестве которого выступает сульфат бария, выпаривания фильтрата, можно получить кристаллы поваренной соли.
- При экзотермическом соединении натрия с газообразным хлором также образуется хлористый натрий, причем процесс сопровождается выделением существенного количества тепла (экзотермический вид).
Рекомендации по снижению потребления соли
- Взрослые. ВОЗ рекомендует взрослым потреблять менее 5 г соли в день (чуть меньше одной чайной ложки) (1).
- Дети. Для детей в возрасте от двух до 15 лет ВОЗ рекомендует корректировать рекомендованное максимальное потребление соли в сторону уменьшения исходя из их потребностей в энергии по сравнению с взрослыми. Эта рекомендация в отношении детей не охватывает период исключительно грудного вскармливания (0–6 месяцев) или период прикорма при продолжающемся грудном вскармливании (6–24 месяца).
- Вся потребляемая соль должна быть йодированной, т.е. обогащенной йодом, который имеет важнейшее значение для здорового развития головного мозга у плода и у детей младшего возраста и общего укрепления психических функций у всех людей.
Биологическая роль
В организме натрий находится большей частью снаружи клеток (примерно в 15 раз больше чем в цитоплазме). Это разницу поддерживает натрий-калиевый насос, который откачивает попавший внутрь клетки натрий.
Совместно с
калиемнатрий выполняет следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1200 до 2300 миллиграмм. В виде поваренной соли это составляет от 3 до 6 грамм в день.
Натрий содержится практически во всех продуктах, хотя большую его часть организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированой пищей
человека не встречается, однако, некоторые проблемы могут возникнуть при вегетарианских диетах. Временный дефицит может быть вызвано использованием мочегонных, поносом, обильным потением или избыточным употреблением воды. Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте, и нарушение усвоения
аминокислот и моносахаридов
. Продолжительный дефицит вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, а так же повышеное выделение калия с мочой. Максимальное количество соли, которое может быть переработано почками составляет примерно 20-30 грамм, большее количество уже опасно для жизни.
Полезные свойства натрия и его влияние на организм
Полезными для организма свойствами натрия являются:
- Нормализация водно-солевого обмена;
- Активизация ферментов слюнной и поджелудочной желез;
- Участие в выработке желудочного сока;
- Поддержание нормального кислотно-щелочного баланса;
- Генерирование функций нервной и мышечной системы;
- Сосудорасширяющее действие;
- Поддержание осмотической концентрации крови.
Усвояемость натрия
Натрий содержится практически во всех продуктах, хотя большую его часть (около 80%) организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонком кишечнике. Витамин D улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию.
Взаимодействие с другими
Повышенное потребление натрия вызывает накопление жидкости в организме, отеки, повышает кровяное давление. Большой прием натрия (соли) приведет к истощению запасов калия, кальция и магния.
Применение натрия в жизни
Применение металлического натрия – химическая и металлургическая промышленность, где он выступает в роли сильнейшего восстановителя. Хлоридом натрия (поваренной солью) пользуются все без исключения жители нашей планеты, это самое известное вкусовое средство и древнейший консервант.
Признаки нехватки натрия
Нехватка натрия обычно случается при чрезмерном потоотделении – в жарком климате или при физических нагрузках. Недостаток натрия в организме характеризуется ухудшением памяти и потерей аппетита, головокружением, быстрой утомляемостью, обезвоживанием, мышечной слабостью, а иногда – судорогами, кожными высыпаниями, желудочными спазмами, тошнотой, рвотой.
Вывод из исследования
Исследователи пришли к выводу, что каждый человек получает пользу от сокращения потребления Na. Однако осталось много вопросов, критики утверждают, что эксперимент был очень кратковременный, для того что бы опровергнуть общепринятые рекомендации. Они поспешили напомнить и о вреде из-за недостатка минерала в крови. Сторонники исследования утверждают, что большинству людей и не нужно больше 1500мг для нормальной жизнедеятельности и здоровья. Из-за непродолжительного времени эксперимента, не удалось установить пользу этой диеты для профилактики риска сердечно-сосудистых заболеваний.
Группой ученых под руководством Гарвардских исследователей были найдены участники экспериментов по профилактике гипертонии (ТОНР), проведенные в 1980 и 1990 годах. Это уже можно назвать долгосрочными экспериментами. Было выявлено, что у людей снизивших потребление натрия до 2000-2600 мг в сутки, почти на 30% меньше случаев сердечно-сосудистых заболеваний, снижена смертность.
Споры о том, что ограничение соли подходит всем, вероятнее всего, будут продолжаться, как и споры практически на все темы здоровья.
Какое влияние соль оказывает на кровяное давление и здоровье человека, зависит от многих вещей, включая:
- Генетическую предрасположенность
- Возраст человека
- Образ жизни
- Физическое здоровье человека.