Общая характеристика фтора
Фтор имеет 9 атомный номер, а его атомная масса составляет 18, 9984031. В таблице химических элементов Менделеева фтор принято обозначать F. Данный компонент является ядовитым. По своей сути фтор является химически активным неметаллом. Он сильнейший кислитель. Среди всех элементов из группы галогенов, фтор является самым легким. При стандартных условиях температуры давления фтор — это двухатомный газ, бледно-желтого цвета, обладающий резким запахом. Напоминает озон или хлор. Формула фтора-F2.
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Нахождение фтора в природе. Где содержится фтор?
В свободном состоянии вторник можно встретить в окружающей среде, так как он является частью соединений с различными элементами. При определенных условиях они распадаются, образуя ионы фтора.
В качестве соединений фтора можно найти в почве, воде, продуктах питания. Данный элемент является жизненно необходимым для здоровья человека, однако, при этом он обладает также и негативными качествами. количество фтора в организме не должна превышать дозволенного сутки нормы, так как это может привести к негативным последствиям. Врачи считают, что взрослому человеку достаточно от 0, 5 ммг до 1-2 ммг. При попадании большего количества фтора в организм могут возникнуть осложнения.
Острое отравление[править | править код]
Источники F
Такое отравление — не редкость. Обычно оно возникает вследствие случайного попадания в организм фторсодержащих инсектицидов или средств против грызунов.
Первые симптомы (слюнотечение, тошнота, боль в животе, рвота и понос) связаны с местным действием соединений фтора на слизистую ЖКТ. Системные симптомы разнообразны и тяжелы: нервное возбуждение (обусловленное, по-видимому, кальцийсвязывающим действием ионов фтора), гипокальциемия и гипогликемия. АД снижается, что можно объяснить как угнетением сосудодвигательного центра, так и прямым кардиотоксическим действием. Дыхание вначале учащается, но затем угнетается. Смерть обычно наступает от остановки дыхания или сердечной недостаточности. Смертельная доза фторида натрия для человека составляет примерно 5 г, хотя и значительно колеблется. Лечение сводится к в/в введению физиологического раствора с глюкозой и промыванию желудка известковой водой (0,15% раствором гидроокиси кальция) или растворами других солей кальция для связывания ионов фтора. При тетании вводят кальция глюконат в/в. С помощью интенсивной инфузионной терапии поддерживают высокий диурез.
Пищевые источники фтора. Из каких продуктов можно получить фтор
Более насыщенные фтором продукты -это чёрный и зелёный чай. Также фтор входит в состав орехов.Богаты им также продукты животного происхождения. К ним относится морская рыба, морепродукты, моллюски, креветки, мидии, скумбрия, треска. Компонент входит в состав зерновых: пшеница, рожь, овес, кукуруза, рис. Также его можно получить из фасоли, гороха, и прочих бобовых. Субпродукты насыщенно фтором не меньше. Говядина, телятина и печень- основные источники данного микроэлемента. Получить его можно также из овощей и фруктов. Наиболее им богатый яблоки, при фрукты, морковь, тыква.
Полезные свойства фтора и его влияние на организм
Организме человека фтор выполняет немало полезных функций. Он отвечает за укрепление иммунитета. Также в Тур участвует в обмене веществ и минерализации костной ткани. Защищает зубную эмаль. Фтор препятствует преждевременному развитию остеопороза, укрепляет костный скелет. Благодаря фтору происходит рост волос и ногтей, он стимулирует кровообращение всего организма.
Фтор не просто так входят в состав многих зубных паст, он помогает защитить зубную эмаль от развития кариеса.Благодаря фтору срастания костей после перелома происходит более быстро. Также данные микроэлемент принимают участие в формировании скелета, И поддерживать его функционирования на протяжении всей жизни. присутствие данного компонента в организме снижают кислотность и бактерий бактерий, мы вызвать проблемы с зубами.
Помогает лучше усваивается железу, он ускоряет процесс выведения из организма радионуклидов и солей тяжёлых металлов. полезные свойства фтора были оценены в медицине. Его соединения входят в состав новых лекарственных препаратов, кровезаменителей, искусственных клапанов сердца.
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
Вред фтора для человека. Негативное воздействие фтора на организм
Вред фтор может принести лишь при большой дозировке, попавшей в организм. Если суточная норма микроэлементов превышается регулярно, у человека возникает тяжелый случай артрита, флюороз костей и зубов. Переизбыток фтора вызывает проблемы в работе эндокринной системы, подавляет функционирование щитовидной и шишковидной железы. Из-за чего в организме нарушаются процессы обмена веществ.
Фтор по своей сути сильнейший нейротоксин, который способствует накоплению алюминия в мозге. Данный компонент может привести к развитию болезни Альцгеймера и ряду нервных и психических расстройств. Однако, не только переизбыток фтора опасен. Если в организме слишком низкий процент компонента развивается кариес, пародонтоз, начинают ломаться ногти и волосы.
Недостаток фтора в организме. Чем чреват дефицит фтора?
Фтор является необходимым компонентом для поддержания здоровья человека. Несмотря на то, что человеку требуется совсем маленькое количество компонента, его недостаток достаточно распространен. Недополучить микроэлемент можно, если перестать получать достаточное количество питьевой воды. При недостаточном количество микроэлемент начинает хуже усваиваться железо, что приводит к развитию железодефицитной анемии и кариеса Также страдает качество зубной эмали, ведь фтор вымывается фторапатитов.
Основные проявления дефицита фтора — кариес зубов и остеопороз. Чтобы избежать развития кариеса необходимо употреблять достаточное количество питьевой воды и продуктов, содержащих фтор. А также использовать зубные пасты, гели, лаки для ногтей, спреи для волос, которые содержат данный микроэлемент. Однако важно понимать, что фтор не является средством лечения кариеса. Он лишь помогает избежать его развития в ротовой полости человека.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
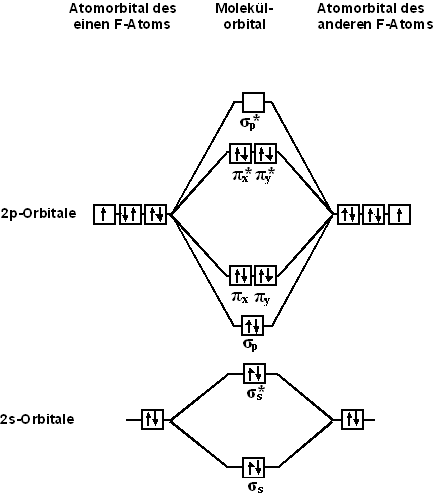
Применение метода МО для молекулы F2
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
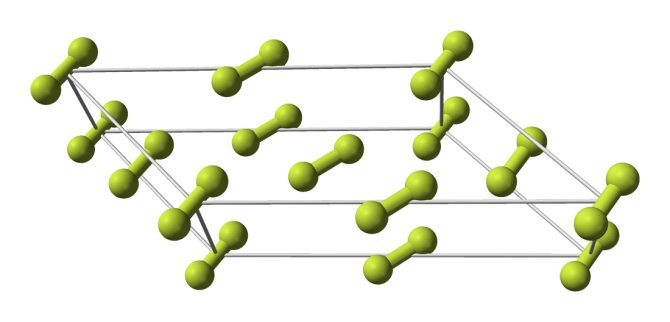
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C
2/
c
, параметры ячейки
a
= 0,54780(12) нм,
b
= 0,32701(7) нм,
c
= 0,72651(17) нм, β = 102,088(18)°,
Z
= 4,
d
= 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм3 (при 10 К); - β-фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm
3
n
, параметры ячейки
a
= 0,65314(15) нм,
Z
= 8,
d
= 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм3 (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2021 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см3, и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см3.
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм.
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Основная статья: Изотопы фтора
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Избыток фтора в организме. Что происходит при переизбытке микроэлемента?
Если человек употребляет слишком много воды, которая содержит фтор, превышая при этом его норма в организме, то у него могут развиться следующие недуги:
- Патологические изменения в строении кости;
- появление меловидные пятна на зубах;
- нарушение прочности эмали;
- развитие флюороза зубов;
- частая тошнота;
- рвота;
- нарушение работы центральной нервной системы;
- снижение артериального давления;
- сбой обменных процессов в организме;
- замедление свертываемости крови;
- развитие флюороза костей.
Наибольший риск переизбытка фтора из питьевой воды наблюдается в северных регионах России, а также в тех местах, где находятся предприятия по производству алюминия.
Как избежать опасного воздействия фтора на организм?
Необходимо выяснить у работников коммунальной службы, обрабатывается ли ваша вода фтором. Если ответ будет положительный, то откажитесь от приготовления пищи в алюминиевой посуде, так как фтор образует с данным компонентом опасное соединение, которое может вызывать развитие заболевания в организме человека. Также не стоит использовать воду из-под крана для приготовления пищи и питья. врачи рекомендуют не употреблять продукты приготовленные в такой воде беременным женщинам и детям, для них воздействие фтора особо опасно. Чтобы избежать негативного воздействия фтора используйте для приготовления пищи минеральную воду.
Получение
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Польза фтора для зубов человека. Нужно ли обрабатывать дополнительно зубы фторидом?
Многие люди даже не задумываются о том что не получают достаточно фтора. Необходимо проводить консультацию с врачом, проверять состояние зубов, чтобы убедиться в том, что им достаточно микроэлемента. Люди, которые принимают медикаменты, вызывающие сухость во рту, должны пройти процедуру фторирования зубов, чтобы повысить их стойкость к образованию кариеса. Также полезна данная процедура будет тем, кто страдает заболеваниями, вызывающими сухость слизистой.
Дополнительно обработать зубы фторидом желательно тем, у кого наблюдается опущение десны. При данной проблеме у бактерий больше шансов попасть на поверхность зуба, что приводит к развитию кариеса и трещин. Особенно необходима данная процедура людям, которые установили себе брекеты. Металлические пластины могут вызывать появление кариозных полостей. Также если вы проходите лучевую терапию головы или шеи, стоит укрепить свои зубы. Данный вид терапии повреждает слюнные железы, приводя к появлению сухости во рту.

Какие существуют виды специальных средств для обработки зубов фторидом?
Провести обработку зубов фторидом вы можете в стоматологической клинике или самостоятельно дома. Однако, лучше довериться профессионалам, которые не нанесут вреда вашим зубам. Врач-стоматолог удалит излишки слюны, а затем нанесет на челюсть специальную пленку или лак, насыщенные фторида. Некоторые стоматологи используют капу, которую наполняет гелем или пеной. Ее необходимо держать не более нескольких минут. После процедуры нельзя ничего есть и пить около получаса, курить также запрещено.
Оцените
Фтор