Белки относятся к веществам органического происхождения. Белки – самые необходимые элементы для живых существ. Непериодические полимеры, к чему относятся белки, отличаются от остальных полимеров.
Первый протеин был выделен в виде клейковины в 1728 году итальянцем Якопо Бартоломео Беккари, проживавшему в 1682-1766 годах, из муки пшеницы. Отмытая клейковина представляет собой комплекс нерастворимых в воде глютенов, к чему относятся белки. С этого момента и началось изучение протеина.
Строение белковых молекул
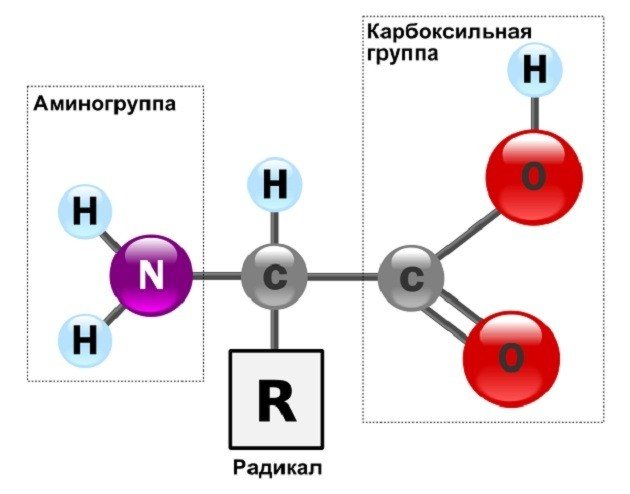
Их молекулы строятся из подобных, но различных мономеров – 20 аминокислот. Каждая из них имеет собственное наименование, строение и свойства. Молекула ее построена из специфического радикала и общей для всех составляющей, куда входит аминогруппа со щелочными свойствами, и карбоксильная группа с кислотными свойствами. Присутствие в одной молекуле обеих групп определяет их высокую степень реактивности.
Эти группы соединяют высокомолекулярные азотсодержащие органические вещества, образовывая новые полимеры, к чему относятся белки. Процесс происходит следующим образом: из аминогруппы одной аминокислоты и карбоксила другой образовывается молекула воды, а свободные электроны связываются, получив пептидную связь. Так образовываются полипептиды. Все, что умеет делать человеческий организм с помощью клеток, — это действие протеинов.
Состав аминокислот
Аминокислоты, как следует из их названия, содержат основную аминогруппу (— NH2), а также кислотную карбоксильную группу (—COOH), обе они связаны с центральным атомом углерода. Углерод дополнительно скреплен с водородом и функциональной белковой группой, называемой радикалом (R). Эти компоненты полностью заполняют все связи центрального атома углерода.
Общая структура α-аминокислот, составляющих белки (кроме пролина). Автор: User:X-romix
Уникальный характер каждой аминокислоты определяется природой группы радикала. Обратите внимание, что если группа радикала не содержит атома водорода (Н), как в глицине, то аминокислота хиральна и может существовать в форме двух энантиомеров: d или L. В белках живых систем содержатся обычно α (L)-аминокислоты, а β (d)-аминокислоты встречаются крайне редко.
Группа радикала определяет химические свойства аминокислот – они могут быть полярными или неполярными, гидрофобными или гидрофильными. Серин с радикалом -CH2OH является полярной молекулой, Аланин, который имеет –CH3 как группу радикала – неполярен.
Существуют также основные аминокислоты (более чем с одной аминогруппой) и кислые аминокислоты (более чем с одной карбоксильной группой). Наличие дополнительной амино- или карбоксильной группы оказывает влияние на свойства аминокислоты, которые играют определяющую роль в формировании пространственной структуры белка.
В состав радикала некоторых аминокислот (например, цистеина) входят атомы серы. Все 20 аминокислот сгруппированы в пять химических классов, основанных на группе их радикала.
- Неполярные аминокислоты, такие как лейцин, часто имеют в качестве радикала —CH2 или —CH3.
- Полярные незаряженные аминокислоты, такие как треонин, с радикалом, содержащим кислород или гидроксильную группу (-OH).
- Заряженные аминокислоты, такие как глутаминовая кислота, с радикалом, имеющим кислоты или основания, способные к ионизации.
- Ароматические аминокислоты, такие как фенилаланин, имеющий группу радикала, содержащую органическое (углеродное) кольцо с чередованием одиночных и двойных связей. Они также неполярны.
- Аминокислоты, обладающие особыми функциями и свойствами. Например, метионин, который часто является первой аминокислотой в цепи белков, пролин, вызывающий перегибы в цепях, цистин, связывающий цепи вместе.
Каждая аминокислота влияет на форму белка по-разному, в зависимости от химической природы боковых групп. Например, части белковой цепи с многочисленными неполярными аминокислотами сворачиваются внутрь своей цепи путём гидрофобного исключения.
Биосинтез в фармации
Знание процессов биосинтеза белка имеет огромное значение и для охраны здоровья, в частности, — для фармации, дает объяснение возникновению генетических заболеваний, решает задачу их профилактики и лечения. Применяется для синтеза фармацевтических препаратов, в том числе антиметаболитов. Эти препараты применяются для остановки процессов биосинтеза белка в онкологии: антимутагенов, охраняющих ДНК от мутаций; радиопротекторов, которые охраняют нуклеиновые кислоты от радиационных изменений.
Биосинтез белка помогает раскрывать принципы воздействия медикаментозных препаратов, таких как антибиотики, тормозящие на различных стадиях биосинтез белков у микроорганизмов и вирусов.
Что относится к белкам?
Белок, или протеин может быть животного или растительного происхождения. Что к каким белкам относится? Огромный источник белка – зеленые растения, соевые продукты, зерна, орехи и бобы. Когда животное употребляет растительную пищу, то в его организме растительный белок превращается в животный. Поэтому животный белок содержится в мясе, молоке, сырых яйцах. У человека есть выбор употреблять растительную или животную пищу, богатую белком.

Усвояемость различных белков
Конечно, белки и в одной и той же группе отличаются своими свойствами. В зависимости, к каким белкам относится продукт, он имеет разную усвояемость. Одни быстро усваиваются и ускоряют метаболизм, а другие могут просто зашлаковать организм. Рассмотрим, какие вещества относятся к белкам.
Лидером среди белков, которые быстро усваиваются, является яйцо. Его нужно съедать после тренировки, ведь яйцо не оставляет после себя прослойку жира как, например, другие белки животного происхождения.
Рыба – отменный источник протеина, она легко усваивается и не вызывает тяжесть в желудке. Что касается животного мяса, то оно несомненный лидер по количеству белка в 100 г. И если съесть 250 г мяса, то наш организм получит суточную норму белка. А вот мясо птицы несколько поступается своим содержанием белка, но оно постное и легче усваивается.
Что касается растительных белков, то лидером выступает соя, в которой содержание белка почти такой же, как и у яйца. Следует добавить к своему рациону орешки семена, белковый процент которых достигает значений мяса птицы, но из-за высокой калорийности их нужно употреблять понемногу.
Влияние белка на контроль сытости человека
Ученые заметили, что некоторые животные из-за колебания белка в рационе начинают вести себя иначе. Это так называемая гипотеза белкового рычага. Её смысл в том, что наши братья меньшие первым делом стараются наполнить организм белком, а уже потом налегают на углеводы и жиры. Таким образом, они контролируют переедание, поскольку протеин снижает чувство голода.
Колебания макронутриентов были описаны с помощью математической модели. Она доказала, что разные люди по всему миру употребляют белок в пределах 10-15 %, а вот пропорции жиров и углеводов сильно отличаются. Наши предки охотники-собиратели ели высокобелковую пищу, которая составляла 20-30 % всего рациона.
Многие считают, что для похудения и поддержания веса стоит лишь увеличить потребление белка. Однако ученые провели ряд исследований и установили, что рацион людей, имеющих лишний вес, содержит почти столько же протеина, что и люди стройные. Таким образом, на похудение влияет не столько увеличение белка, а сокращение количества продуктов с высоким гликемическим индексом. К тому же было доказано, что длительные белковые диеты приводят к проблемам со здоровьем.
При этом нельзя отрицать положительное влияние белков на организм человека. Белок отлично насыщает организм и помогает контролировать голод. Как с умом применять это свойство белкового рычага?
- Правильная пища. Лучше отдать предпочтение цельным, содержащим протеин продуктам и не злоупотреблять их комбинациями с жирами и углеводами (например, совместно употребление картофеля с мясом). Поскольку в этом случае, чтобы набрать норму белков, вам придется «за компанию» съесть слишком много углеводов и жиров.
- Белок на завтрак. Этот способ гарантированно снижает аппетит в течение дня на 51 %. Первый прием пищи с высоким содержанием протеинов оправдан и даже показан всем, кто беспокоится и следит за фигурой и качеством тела в целом.
- Любой прием пище рекомендуется начинать с белков. Сразу вспоминается древнее выражение «Ab ovo», что в переводе означает «начнем с яйца». Протеин в начале трапезы, так же как овощной салат, помогает сократить количество потребляемых калорий.
- В дни, когда у вас появляется сильный аппетит, съедайте много белка. А в периоды покоя сокращайте его количество, устраивая перерыв.
Использование белков, углеводов и жиров в рационе
Если подходить к питанию с точки зрения науки, то человеку требуются не конкретные продукты питания, а их элементы для роста и жизнедеятельности организма. Это 3 группы веществ: белки, жиры, углеводы. Все они должны присутствовать в конкретном количестве каждый день, в противном случае возможны сбои в организме и ухудшение здоровья. Также имеется некоторое соотношение между этими веществами, которого необходимо придерживаться.
Диетологи рекомендуют строить свой рацион, учитывая следующую норму: 15% белков, 20% жиров и 65% углеводов. Конечно, это средняя пропорция: она зависит от конкретного организма, параметров роста, веса и возраста человека. Поэтому субъективные цифры следует определять, обратившись к диетологу или тренеру.
Биологическое значение
Б. выполняют многочисл. функции. Обмен веществ (пищеварение, дыхание, выделение и др.) и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимич. реакций, являющихся Б. Защитные системы высших организмов формируются защитными Б., к которым относятся иммуноглобулины, Б. комплемента, цитокины иммунной системы, Б. системы свёртывания крови (в т. ч. плазмин, тромбин, фибрин). Важную группу составляют регуляторные Б., контролирующие биосинтез Б. и нуклеиновых кислот. К их числу относятся также пептидно-белковые гормоны. Информация о состоянии внешней среды, разл. регуляторные сигналы воспринимаются клеткой с помощью рецепторных Б., располагающихся на наружной поверхности плазматич. мембраны. За передачу сигналов внутрь клетки ответственны Б. сигнальных систем ($\ce{G}$-белки, Б.-эффекторы), которые играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксис). В активном транспорте ионов, липидов, сахаров и аминокислот через биологич. мембраны участвуют транспортные Б., или Б.-переносчики. Среди них, напр., гемоглобин и миоглобин, осуществляющие перенос кислорода. Основу костной и соединит. тканей, шерсти, роговых образований составляют структурные Б. (в т. ч. коллаген, кератин, эластин). Они же формируют клеточный скелет и межклеточный матрикс. Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве Б. сократительной системы (актина, миозина, тропомиозина, тубулина и др.). Б. – важнейшая составная часть пищи человека и кормов животных. Особое значение при этом имеют запасные Б. растений и животных (напр., казеин, проламины). Преобразование и утилизация энергии, поступающей в организм с пищей, а также энергии солнечного излучения происходят при участии Б. биоэнергетической системы (напр., родопсина, цитохромов). Среди пептидно-белковых веществ имеются антибиотики (в т. ч. грамицидины, полимиксины, энниатины), токсины и др. биологически активные вещества.
Работа протеинов
Высокомолекулярные биологические соединения, к чему относятся белки, расщепляются до аминокислот, которые проникают в кровь и насыщают организм, а он применяет их для строительства своих протеинов. Чтобы тело приобрело крепкие мускулы и красивый подтянутый вид, необходимо пополнять рацион белками. Их достаточно в рыбе и мясе, яйцах и сыре, бобовых и соевых продуктах. Рассчитывать рацион следует исходя из дневной нормы всех ингредиентов, а также из поставленных целей.

Тем, кто желает подкачать мышцы, стоит повысить прием белков, а худеющим следует снизить употребление высокоуглеводной и жирной пищи. Белки, жиры, углеводы относятся к главным источникам энергии и силы. В среднем, человеку для здорового питания и поддержания нормального веса, необходимо принимать с едой белки, жиры, углеводы в такой пропорции: 90-110/90-100/250-300 г. Для детей эти цифры немного меньше.
Белковые продукты и ежедневная порция:
- курица, индейка, постная ветчина — 75 г;
- свинина, баранина, говядина — 45 г;
- жирная рыба – 30 г; постная рыба, морепродукты – 60 г;
- фасоль, чечевица – 2 ст. л.;
- бекон — 1 постный ломтик;
- рыбные палочки – 2 шт.;
- хумус пониженной жирности – 1 ст. л.;
- яйца — 1 шт.;
- орехи — 15 г.
Мышцы строятся из белка, а пища человека должна обязательно содержать его, ведь он источник силы. Белки рыбы и птицы усваиваются лучше всего. Такие продукты, как бобовые, крупы, и соя тоже содержат белки, и притом незначительное количество жира, от них не отстают сыры и кисломолочные продукты.
Вред от белковой пищи
Польза протеиновой еды не отменяет ее опасности. Ведь большинство таких продуктов (особенно животных) считаются «тяжелыми» для организма. Ограничения касаются людей со следующими проблемами здоровья:
- печеночная недостаточность;
- проблемы ЖКТ: язва желудка, гастрит, дисбактериоз.
Имеется в виду не полный отказ от такой пищи, а зацикленность на белковых диетах. Прежде чем их начинать, консультируются с лечащим врачом.
Здоровым людям она не противопоказана, но не более четырех недель. Доминирование протеинов в ущерб жирам или углеводам влечет нарушение баланса. Это чревато сбоями при обмене веществ, работе мочеполовой системы. Волосы и ногти станут ломкими, кожа сухой. А поклонник протеиновой пищи – нервным, раздражительным, тревожным.
Белковая диета
Модная и действенная диета, однако, содержит подводные камни. Решив похудеть или сделать мышцы красивыми, задействуя такие продукты, учитывают следующее:
- Не каждое насыщенное полипептидами блюдо или продукт полезно. Чтобы насытиться, не набивая организм тяжелой едой, выбирают нежирные малокалорийные варианты.
- Исключено переработанное мясо: колбаса, сосиски, паштеты. Эти продукты напичканы «улучшителями» вкуса, ароматизаторами, консервантами, жирами. Не нужны майонезы, соусы, сырковые массы. Их состав сводит на нет полезность природных нутриентов.
- Чтобы количество белков, других полезных компонентов мяса сохранить максимально, его варят, тушат, запекают или готовят на пару.
- Подсчитано, сколько же белка способен усвоить организм за один прием – 30-35 г. Поэтому «переводить» продукты ни к чему. Лучше кушать не трижды в день, а пять-шесть раз.
- Основную (протеиновую) еду дополняют овощами, фруктами, кашами, кисломолочными продуктами. Такое сочетание гарантирует здоровье организма.
- На ночь, за час-полтора до сна, допустим стакан нежирного йогурта или кефира.
- Протеины – исходник номер один для строительства мышечной ткани. Поэтому диету стоит дополнять физическими нагрузками или активным отдыхом. Осиная талия, красивая пятая точка, упругая грудь не будут фантастикой.
- Протеиновую диету рекомендуют применять не чаще раза в полугодие. При проблемах со здоровьем необходимость, длительность и периодичность устанавливает лечащий врач.
- Подходящий рацион для протеиновой диеты: яйца, нежирные кисломолочные продукты, соевый сыр (тофу), мясо, филе лосося, все бобовые, цельнозерновой хлеб.
Выдержать чистоту эксперимента три-четыре недели сложно.
Чтобы не было совсем тоскливо, протеиновый рацион можно пару раз разбавить продуктами типа орешков, печеной или вареной картошки, творожка средней жирности. Однако сало, булочки, конфеты, картошечка фри, другие подобные жиры или углеводы запрещены однозначно.
Особая статья – протеиновый порошок (коктейль). Это продукт из белков, исключающий присутствие жиров. Усваивается моментально, способствует наращиванию мышц, делает фигуру рельефной. Полезен, если диета дополняется спортом.
Интересное о белках
Свыше 4 миллиарда лет назад на планете Земля из незначительных неорганических молекул невероятным образом появились белки, которые стали зарождением жизни. Все живое существует благодаря уникальным молекулам белка, и другие формы жизни во Вселенной ученым пока неизвестны.
- Каждый живой организм создан из белков. Они занимают около 50% сухого вещества любого из организмов. Вирусы содержат протеина от 45 до 95%.
- Примерно 30% протеина человека приходит на мускулы, около 20% — на кости и сухожилия, и около 10% — на кожу.
- Насчитывается 1012 разных белковых веществ, дающие жизнь организмам всех ступеней сложности, от вирусов к людям.
- Мозг – это тоже протеин. Следует помнить, что вследствие процесса денатурации белка при попадании в организм этилового спирта, отмирают клетки мозга.
- Своим наименованием белки обязаны белку яйца, именно его с древних пор употребляли люди как составляющую еды.
- Роль белков в организме самая разнообразная, они могут выступать в роли ферментов. Пепсин — фермент, расщепляющий белки до аминокислот в организме.
- Протеины обладают защитным действием. Интерферон – это протеин, спасающий человеческий организм от вторжения вирусов.
- Белки могут играть роль гормонов, примером служит гормон инсулин. Он содействует поступлению глюкозы в клетку.
- Протеины реализовывают энергетическую задачу для организма.
- Волосы состоят из чистого белка.
Структуры белка
Существуют 4 пространственных организации белковых молекул:
- первичная — создана пептидными связями, именно она определяет свойства молекул белка;
- вторичная, имеющая форму растянутой пружины, построена из пептидных и водородных связей (сухожилия, ногти, волосы, паутина);
- третичная, имеющая форму шара, построена из пептидных, водородных и дисульфидных связей (ферменты, антитела, гормоны);
- четвертичная — состоит из альфа- и бета-цепочек (гемоглобин).
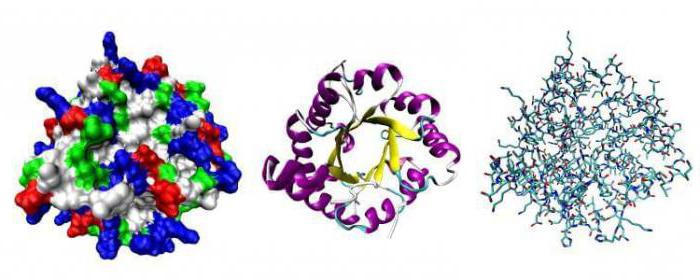
Каждому белку присвоен генетический код, где хранится информация о том, какую форму он должен принять, но генетики и сейчас не умеют предугадывать по первичному коду его пространственную структуру. Для работы белка, ему необходимо свернуться определенным образом.
Очень важно знать, какие продукты питания содержат белок, какой он и сколько его необходимо употреблять. Почему? А потому, что белок, сгорая в организме, насыщает его большим количеством энергии. Именно после высокобелковой пищи, мы чувствуем прилив сил, именно белок выстраивает каждый наш мускул и творит красивое и здоровое тело. Не менее важным считается тот факт, что белок помогает похудеть или удержать вес после похудения.
Уровни структурной организации белков
Форма белка определяет его функцию. Один из способов изучить что-то столь же маленькое как белок – посмотреть на него при помощи коротковолнового излучения, которое представлено рентгеновскими лучами. Рентгеновские лучи пропускают через белок для получения дифракции его узора. Эта картинка кропотливо анализируется и позволяет исследователю построить трёхмерное изображение молекулы с положением каждого её атома. Первым белком, проанализированным таким образом, был миоглобин; вскоре такому же анализу был подвергнут связанный с ним белок гемоглобин.
Когда было изучено достаточное количество протеинов, стал очевиден общий принцип их строения: в каждом исследованном белке все внутренние аминокислоты, такие как лейцин, валин и фенилаланин, неполярны. Тенденция воды к исключению неполярных молекул буквально толкает такие части цепи аминокислот внутрь протеина. Неполярные аминокислоты вынуждены тесно контактировать друг с другом, оставляя мало свободного места внутри молекулы. Полярные и заряженные аминокислоты концентрируются на поверхности белка, за исключением немногих, играющих ключевые функциональные роли.
Структура белков, как правило, описывается как иерархия четырёх уровней: первичного, вторичного, третичного и четвертичного. Мы рассмотрим эту точку зрения, а затем интегрируем её с более современным подходом, вытекающим из расширяющихся знаний о белковой структуре.
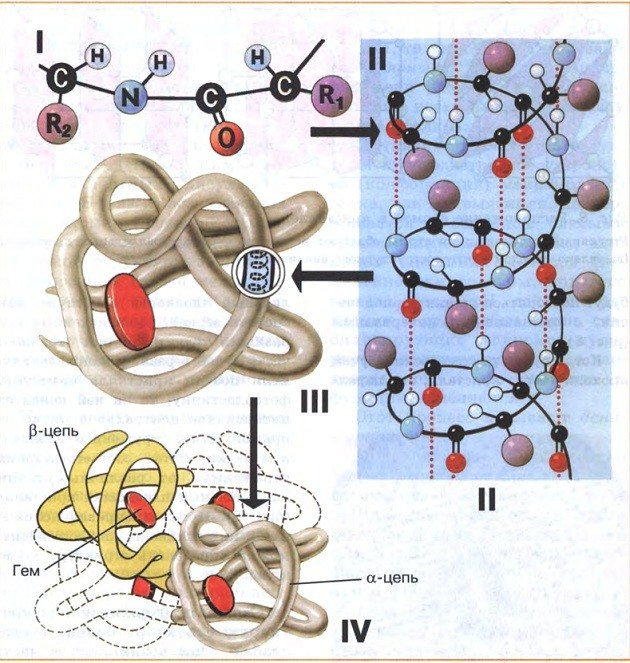
Уровни организации молекул белка
Первичная структура белков
Первичная структура белка – это его аминокислотная последовательность, т. е. это цепочка из множества аминокислотных остатков, соединённых пептидными связями. Это наиболее важная структура, так как именно она определяет форму, свойства и функции белка. На основе первичной структуры создаются другие формы молекулы.
Группы радикалов, которыми отличаются аминокислоты, не играют роли в пептидной цепи белков и протеин может включать любую последовательность аминокислот. Так как любая из 20 аминокислот может появиться в любом месте, белок, содержащий 100 мономеров, может образовать любую из 20 100 различных аминокислотных последовательностей. Это важное свойство белков позволяет им быть разнообразными, но каждый из них функционирует только при определённой аминокислотной последовательности.
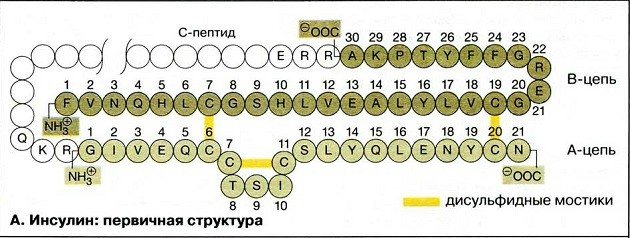
Вторичная структура белка
Боковые и пептидные группы полипептидных цепей могут образовывать водородные связи. Вторичная структура белка возникает в результате связывания атомов водорода NH-групп и кислорода CO-групп. Полипептидная цепь при этом спирально закручивается. Водородные связи слабые, но благодаря их большому числу они обеспечивают стабильность этой структуры. Спиральную конфигурацию имеют, например, молекулы кератина, миозина и коллагена.
Водородные связи пептидов могут образовываться с водой. Если связей с водой будет слишком много, белки не смогут приобрести глобулярной структуры. Лайнус Полинг предположил, что пептидные группы могут взаимодействовать друг с другом, если пептид свёрнут в спираль, которую он назвал α-спиралью. Этот вид регулярного взаимодействия в пептиде формирует его вторичную структуру.
Вторичная структура инсулина
Другая форма вторичной структуры формируется между зонами пептида, расположенными в один ряд, в результате чего получается плоская молекула, собранная в складки, называемая β-листом. Части белка могут быть либо параллельными, либо антипараллельными – в зависимости от того, являются ли смежные участки пептида ориентированными в одном или в противоположном направлении.
Эти два вида вторичной структуры создают зоны белка – цилиндрические (α-спирали) и плоские (β-листы). Конечная структура белка может включать области каждого типа вторичной структуры. Например ДНК-связывающие белки обычно имеют области α-спирали, которые могут лежать поперёк ДНК и взаимодействовать непосредственно с основаниями ДНК. Белки порины, образующие отверстия в мембранах, состоят из β-листов. В гемоглобине α и β-структуры (глобины) имеют в молекуле свои зоны.
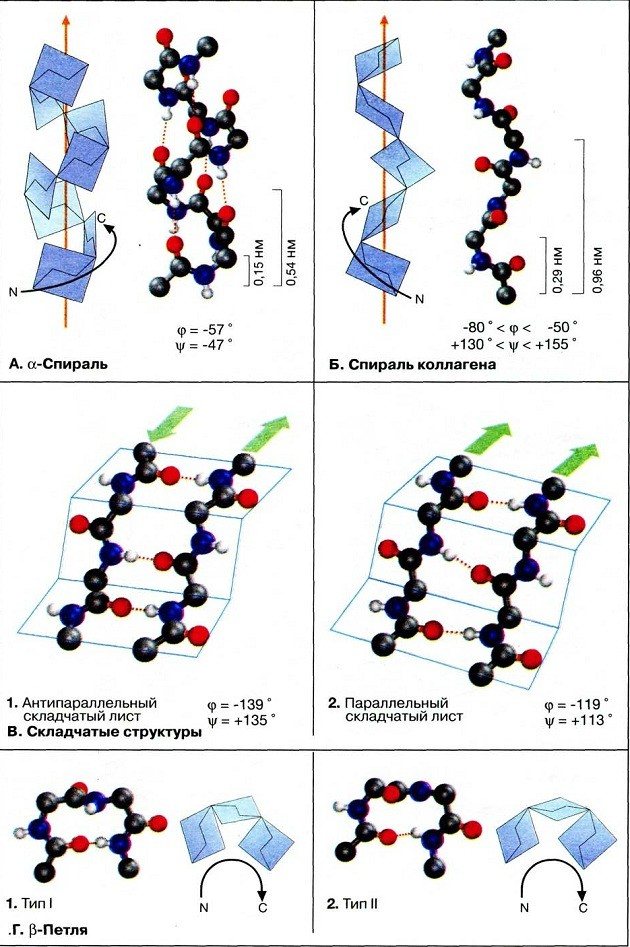
Вторичная структура белков
Третичная структура белков
Окончательная структура химически связанных белков называется третичной. Третичная структура формируется за счет образования водородных, ионных и других связей, возникающих в водной среде между разными группами атомов белковой молекулы вторичной структуры.
У некоторых белков важную роль в образовании третичной структуры играют S – S связи (дисульфидные) между остатками цистеина (аминокислоты, содержащей серу). При этом полипептидная спираль укладывается в своеобразный клубок (глобулу) таким образом, что гидрофобные аминокислотные радикалы погружаются внутрь глобулы, а гидрофильные располагаются на поверхности и взаимодействуют с молекулами воды. Третичной структурой определяются специфичность белковых молекул, их биологическая активность. Её имеют многие белки, например миоглобин (белок, который участвует в создании запаса кислорода в мышцах) и трипсин (фермент, расщепляющий белки пищи в кишечнике).
Третичная структура стабилизируется рядом сил, в том числе:
- водородными связами между радикалами различных аминокислот;
- электростатическим притяжением радикалов с противоположными зарядами;
- гидрофобным исключением неполярных радикалов;
- ковалентными дисульфидными связами.
На стадии третичной структуры по форме молекул белки можно разделить на две группы:
- глобулярные – имеют округлую форму. Такую форму имеют глобулины и альбумины крови, фибриноген, гемоглобин;
- фибриллярные – характеризуются вытянутой, нитевидной формой молекул. Это кератин, коллаген, миозин, эластин и др.

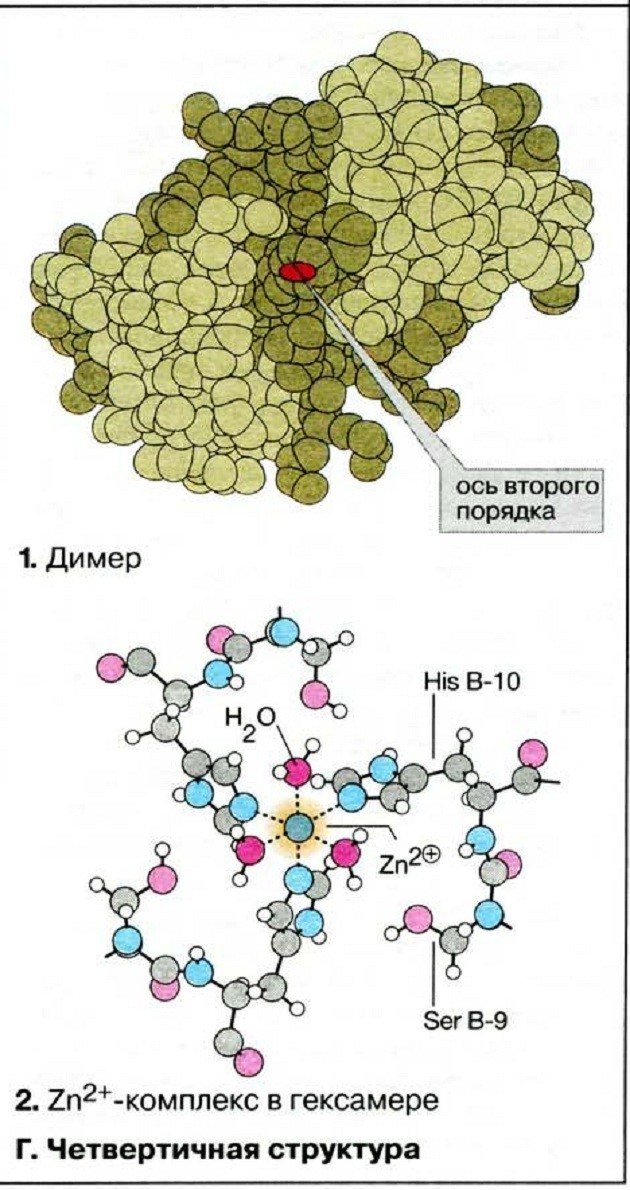
Четвертичная структура белка
Когда два или более полипептида связываются с образованием функционального белка, отдельные его цепи называются субъединицами. Расположение этих субъединиц и есть четвертичная структура. Субъединицы в таких белках чаще всего неполярны, поэтому они не связаны химически и отвечают за отдельные виды деятельности. Прочность четвертичной структуры обеспечивается взаимодействием слабых межмолекулярных сил.
Четвертичная структура характерна для белка гемоглобина. Вспомните, что гемоглобин состоит из двух α-цепей и двух β-цепей, а ещё в его состав входит небелковый компонент – гем.
Субъединицы располагаются в их окончательной четвертичной структуре. Это конечная структура некоторых, но не всех белков. У протеинов, которые состоят только из одной полипептидной цепи, например у фермента лизоцима, конечной структурой является третичная.
Мотивы и домены – структурные элементы белков
Ручное определение последовательности аминокислот в белке – трудоёмкая работа. Эту ситуацию изменило открытие способности хранения информации о белке молекулой ДНК. Первоначально геном человека был расшифрован вручную. Появление технологий следующего поколения привело к заметному ускорению секвенирования.
Сегодня расшифрованы более 40 000 бактериальных геномов и почти 8 000 геномов эукариот, в том числе 80 последовательностей генов млекопитающих. Так как состав ДНК имеет непосредственное отношение к последовательности аминокислот в белках, у биологов теперь есть огромная база данных строения протеинов.
Новая информация заставила задуматься о логике генетического кода и основных закономерностях структуры белка. Исследователи до сих пор рассматривают иерархическую систему из четырёх уровней как важную, но в лексикон биологов вошли и новые термины: мотив укладки и белковый домен.
Мотив укладки белковых молекул
Когда биологи обнаружили третичную структуру белка (ещё более трудоёмкая работа, чем определение последовательности аминокислот в цепи), они заметили сходные элементы, расположенные в непохожих белках. Подобные структуры называются мотивами, а иногда «сверхсекундными структурами». Термин «мотив» заимствован из искусства и относится к тематическому повторяющемуся элементу в музыке или дизайне.
Один общий мотив β-α-β образует так называемую «складку Россмана» у большого количества протеинов. Вторым часто встречающимся мотивом является β-баррель, который представляет собой β-лист, сложенный по кругу, чтобы сформировать трубку. Третий тип мотива – спираль-поворот-спираль, состоит из двух α-спиралей, разделённых изгибом. Его используют белки для связывания с молекулой ДНК.
Логику структуры мотивов укладки исследователи до сих пор не могут понять. Вероятно, если аминокислоты являются буквами в языке белков, то мотивы представляют собой повторяющиеся слова или фразы. Мотивы укладки помогли определить неизвестные функции белков, а база данных белковых мотивов используется для поиска новых неизвестных протеинов.
Мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков.
Белковые домены
Домены – это функциональные единицы в виде глобулы внутри более крупной структуры белков. Их можно рассматривать как субструктуры внутри третичной структуры белка. В языке белков это «абзацы». Большинство белков состоит из нескольких доменов, которые выполняют различные части функций протеинов.
Во многих структурах эти домены могут быть физически разделены. Например, так устроены факторы транскрипции – белки, которые связываются с ДНК и инициируют построение РНК по комплементарной ей ДНК. Было выяснено, что если ДНК-связывающие области поменять местами с факторами транскрипции, специфичность фактора может быть изменена без изменения его способности стимулировать транскрипцию. Эксперименты по замене доменов были проведены со многими факторами транскрипции, и они указывают, что активационные и ДНК-связывающие домены действуют отдельно.
Эти образования также могут помогать протеинам складываться. По мере того, как полипептидная цепь приобретает свою структуру, домены принимают правильную форму. Это действие может быть продемонстрировано экспериментально. Искусственное продуцирование фрагмента полипептида, который образует домен в интактном белке, показывает, что фрагмент складывается, чтобы сформировать такую же структуру, как у прототипа.
Продукты, относящиеся к белкам
Недаром белковые диеты признаны самыми результативными среди диетологов, ведь организм тратит на переработку белковой пищи много энергии, около 5-10% поступивших калорий.
Список самых белковых продуктов.
- В куриных яйцах содержится 17% легкоусвояемого протеина. Диетологи советуют принимать в пищу яйца после физических нагрузок, но не более 2 штук в день для возобновления ткани мышц. При этом яйца — это продукт с низкой калорийностью.
- Творог обезжиренный содержит 25% белка, он легко усваивается.
- Твердый сыр имеет около 30% белка, но следует помнить, что он слишком калорийный, и чем он жирнее, тем меньше в нем содержится протеина.
- Мясо птицы — основной источник диетического питания, так как калорийность его небольшая и отлично усваивается. Мясо птицы содержит от 15 до 20% белка.
- Говядина низкокалорийный продукт и щедрый на белок. Всего одна порция нежирной говядины содержит около 22 г белка.
- Печенка состоит из 25% белка. В отварном и тушеном виде очень полезна, так как она богата другими необходимыми элементами.
- Некоторые сорта рыбы содержат белка до 25%, например, тунец, лосось, скумбрия. Такую рыбу можно использовать в пищу без боязни поправиться.
- Самым богатым на белок продуктом из растений считается соя, в ней содержится протеина 14%, из овощных лидеров — брюссельская капуста (9%).
- Крупы содержат не менее 10% белка, который превосходно усваивается организмом.

Это основные продукты, относящиеся к белкам. Список, который здесь приведен, далеко не полный, но учитывает основные потребности организма в белке.
Суточная норма употребления белка
Сколько белка нужно человеку в сутки, зависит от пола, массы тела, стиля жизни, физических кондиций организма. Норма рассчитывается в граммах на килограмм массы тела человека. При малоподвижном образе жизни (г/кг массы тела):
- норма белка в день для женщин – 1,00;
- для мужчины – 1,20.
Приверженцы активного стиля жизни, включая посещение спортивного или тренажерного зала:

- норма белка для женщины – 1,20;
- мужчины – 1,56-2,00.
Подросткам и беременным женщинам требуется 1,20-1,50 граммов ежесуточно. Посчитать, сколько граммов белка нужно человеку, несложно. Например, подростку с массой тела 20 кг требуется 24-30 граммов ежесуточно.