Белки относятся к веществам органического происхождения. Белки – самые необходимые элементы для живых существ. Непериодические полимеры, к чему относятся белки, отличаются от остальных полимеров.
Первый протеин был выделен в виде клейковины в 1728 году итальянцем Якопо Бартоломео Беккари, проживавшему в 1682-1766 годах, из муки пшеницы. Отмытая клейковина представляет собой комплекс нерастворимых в воде глютенов, к чему относятся белки. С этого момента и началось изучение протеина.
Строение белковых молекул
Их молекулы строятся из подобных, но различных мономеров – 20 аминокислот. Каждая из них имеет собственное наименование, строение и свойства. Молекула ее построена из специфического радикала и общей для всех составляющей, куда входит аминогруппа со щелочными свойствами, и карбоксильная группа с кислотными свойствами. Присутствие в одной молекуле обеих групп определяет их высокую степень реактивности.
Эти группы соединяют высокомолекулярные азотсодержащие органические вещества, образовывая новые полимеры, к чему относятся белки. Процесс происходит следующим образом: из аминогруппы одной аминокислоты и карбоксила другой образовывается молекула воды, а свободные электроны связываются, получив пептидную связь. Так образовываются полипептиды. Все, что умеет делать человеческий организм с помощью клеток, — это действие протеинов.
Тонкости строения
При рассмотрении вопроса, из чего состоят белки, стоит изучить и структуру этого вещества. Выделяют:
- Первичную структуру. За основу берется чередование аминокислот в составе. Если включается или «выпадает» хотя бы один элемент, то формируется новая молекула. Благодаря такой особенности, общее число последних достигает астрономической цифры.
- Вторичную структуру. Особенность молекул в составе белка такова, что они находятся не в растянутом состоянии, а имеют различные (иногда сложные) конфигурации. Благодаря этому, жизнедеятельность клетки упрощается. Вторичная структура имеет вид спирали, сформированной из равномерных витков. При этом соседние витки отличаются тесной водородной связью. В случае многократного повторения устойчивость возрастает.
- Третичная структура формируется, благодаря способности упомянутой спирали укладываться в клубок. Стоит знать, что состав и строение белков во многом зависит от первичной структуры. Третичная база, в свою очередь, гарантирует удержание качественных связей между аминокислотами с различными зарядами.
- Четвертичная структура характерна для некоторых белков (гемоглобина). Последний формирует не одну, а несколько цепей, которые отличаются по первичной структуре.
Секрет молекул белка — в общей закономерности. Чем больше структурный уровень, тем хуже удерживаются между собой образующиеся химические связи. Так, вторичная, третичная и четвертичная структуры подвержены действию радиации, высоких температур и прочих условий окружающей среды. Итогом часто становится нарушение строения (денатурация). При этом простой белок в случае изменения структуры способен к быстрому восстановлению. Если же вещество подверглось негативному температурному действию или влиянию других факторов, то процесс денатурации необратим, а само вещество не подлежит восстановлению.
Биосинтез в фармации
Знание процессов биосинтеза белка имеет огромное значение и для охраны здоровья, в частности, — для фармации, дает объяснение возникновению генетических заболеваний, решает задачу их профилактики и лечения. Применяется для синтеза фармацевтических препаратов, в том числе антиметаболитов. Эти препараты применяются для остановки процессов биосинтеза белка в онкологии: антимутагенов, охраняющих ДНК от мутаций; радиопротекторов, которые охраняют нуклеиновые кислоты от радиационных изменений.
Биосинтез белка помогает раскрывать принципы воздействия медикаментозных препаратов, таких как антибиотики, тормозящие на различных стадиях биосинтез белков у микроорганизмов и вирусов.
Источники растительного белка для вегетарианцев
Если вы не употребляете продукты животного происхождения, ваша главная задача – подобрать рацион, который обеспечит организм всеми необходимыми компонентами.
Вы должны учесть, что, например, рис содержит слишком мало лизина, чтобы считаться полноценным источником белка. Но употребляя его с фасолью или салатом с чечевицей, вы получите все девять незаменимых аминокислот.
Какие продукты растительного происхождения содержат большое количество белков?
- Киноа – это зерно без глютена, которое содержит 8 граммов белка на 1 приготовленную чашку (185 граммов). В состав крупы входит множество полезных минералов, в том числе магний, железо и цинк.
- Тофу – сыр, который изготавливается из соевого молока. Употребление 85 г дает приблизительно 8 г белка. Содержит кальций, калий и железо.
- Гречневая крупа. Одна чашка (168 грамм) вареной гречневой крупы дает приблизительно 6 грамм белка. Является источником многих важных минералов, включая фосфор, марганец, медь, магний и железо.
- Спирулина – разновидность сине-зеленых водорослей, 1 столовая ложка (7 г) высушенной спирулины дает 4 г белка. Она богата антиоксидантами и является источником нескольких витаминов группы В, меди и железа.
- Семена чиа. Две столовые ложки (28 г) семян дают 4 грамма белка. Является хорошим источником Омега-3, железа, кальция, магния и селена.
- Рис и бобы – классическое сочетание, которое является источником полноценного белка. Одна чашка (239 г) риса и бобов дает 12 г белка и 10 г клетчатки.
- Орехи. Например, 30 г миндаля дает 6 граммов белка, почти столько же содержится в 30 г жареного стейка рибай.

Продукты растительного происхождения, содержащие много белка
Что относится к белкам?
Белок, или протеин может быть животного или растительного происхождения. Что к каким белкам относится? Огромный источник белка – зеленые растения, соевые продукты, зерна, орехи и бобы. Когда животное употребляет растительную пищу, то в его организме растительный белок превращается в животный. Поэтому животный белок содержится в мясе, молоке, сырых яйцах. У человека есть выбор употреблять растительную или животную пищу, богатую белком.

Дополнительные источники белка
Здоровым источником белка можно назвать «Изоляты». Это очищенные белки животного и растительного происхождения, в нужном соотношении, с высокой степенью усвоения и без лишних калорий.
Сочетание в рационе белков из пищи и протеиновых коктейлей позволяет поддерживать белковый баланс, а также очень комфортно и эффективно снижать вес.

Усвояемость различных белков
Конечно, белки и в одной и той же группе отличаются своими свойствами. В зависимости, к каким белкам относится продукт, он имеет разную усвояемость. Одни быстро усваиваются и ускоряют метаболизм, а другие могут просто зашлаковать организм. Рассмотрим, какие вещества относятся к белкам.
Лидером среди белков, которые быстро усваиваются, является яйцо. Его нужно съедать после тренировки, ведь яйцо не оставляет после себя прослойку жира как, например, другие белки животного происхождения.
Рыба – отменный источник протеина, она легко усваивается и не вызывает тяжесть в желудке. Что касается животного мяса, то оно несомненный лидер по количеству белка в 100 г. И если съесть 250 г мяса, то наш организм получит суточную норму белка. А вот мясо птицы несколько поступается своим содержанием белка, но оно постное и легче усваивается.
Что касается растительных белков, то лидером выступает соя, в которой содержание белка почти такой же, как и у яйца. Следует добавить к своему рациону орешки семена, белковый процент которых достигает значений мяса птицы, но из-за высокой калорийности их нужно употреблять понемногу.
В основу классификации белков положены их физико-химические и химические особенности. Белки классифицируют по нескольким признакам.
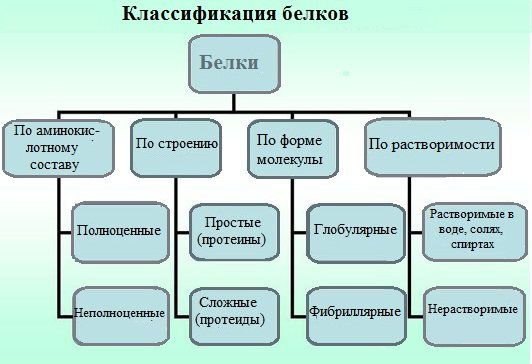
1.По строению
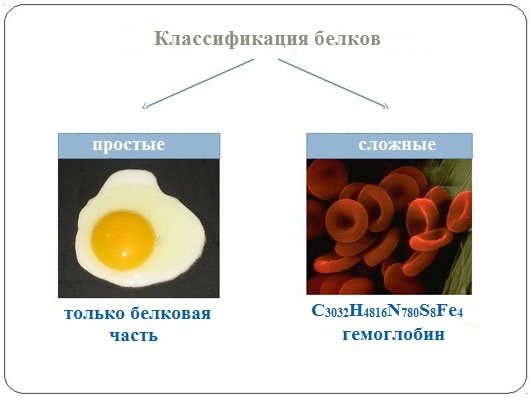
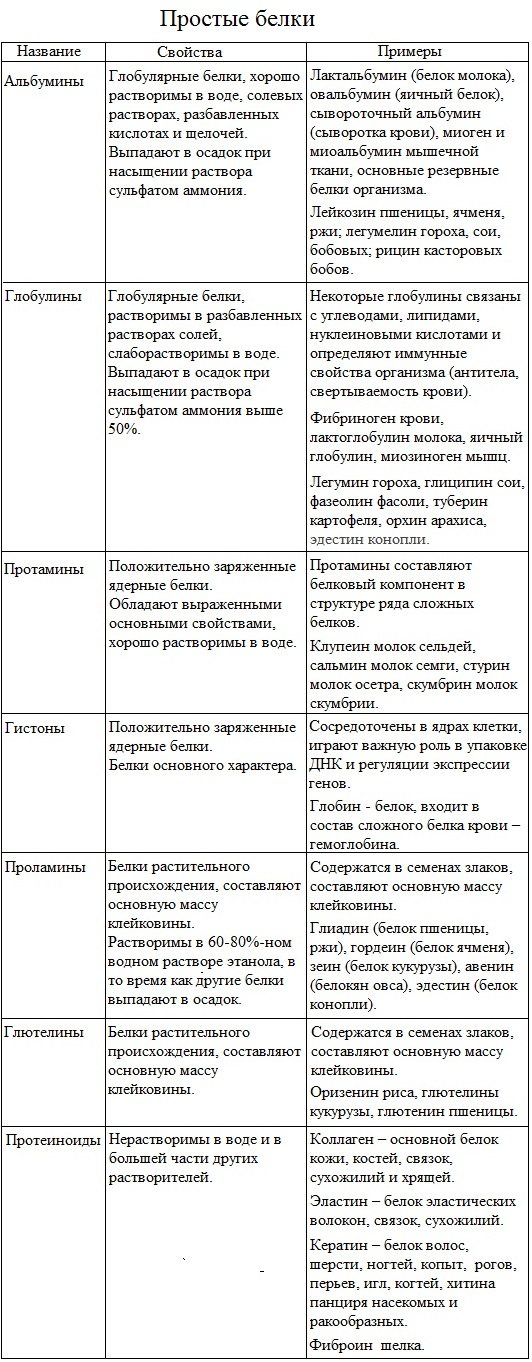
По химическому строению молекул все белки подразделяют на простые и сложные.
Простые белки (протеины) состоят только из аминокислот.
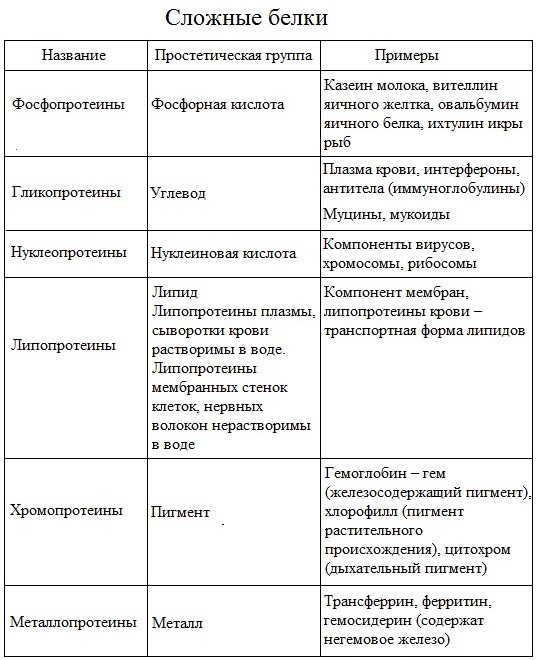
Сложные белки (протеиды) состоят из глобулярных белков и небелкового компонента. Небелковая часть сложного белка называется простетической группой.
Простетическая группа может быть представлена различными по химической природе соединениями. В зависимости от ее строения и свойств сложные белки подразделяются:
- хромопротеины – содержат в качестве небелковой части окрашенный компонент (гемоглобин, миоглобин, цитохромы, хлорофилл);
- гликопротеины – содержат углеводы;
- нуклеопротеины – содержат нуклеиновые кислоты;
- липопротеины – содержат липиды;
- фосфопротеины – содержат остаток ортофосфорной кислоты;
- металлопротеины – содержат комплексно связанный металл.
Простые белки
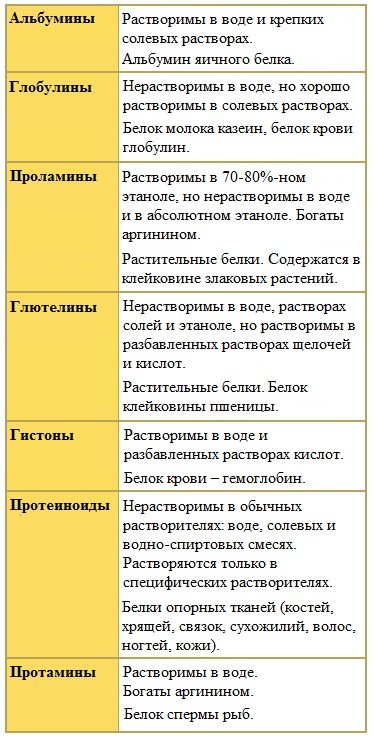
К простым белкам относят альбумины, глобулины, протамины, гистоны, проламины, глютелины, протеиноиды.
Альбумины и глобулины белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. На долю альбуминов приходится более половины белков плазмы крови.
Альбумины
Альбумины – составляют основную часть белков животных и растительных тканей. Альбумины – это глобулярные белки.
Альбумины – белки относительно небольшой молекулярной массы 25000-70000, они имеют выраженный кислый характер, так как содержат большое количество аспарагиновой и глутаминовой кислот.
Они растворяются в чистой воде и разбавленных растворах кислот, щелочей и солей. Из водных растворов альбумины осаждаются сернокислым аммонием только при полном насыщении раствора, т.к. это сильно гидратированые белки.
При кипячении свертываются и выпадают в осадок в виде густых хлопьев денатурированного белка. Образование пенки на молоке, загустение содержимого яиц при варке объясняется денатурацией альбуминов. Пена, образующаяся при варке плодов и овощей, частично состоит из свернувшихся растительных альбуминов.
Альбумины – белки преимущественно животного происхождения. К ним относятся альбумины сыворотки крови, лактальбумин молока, овальбумин яичного белка, миоальбумин мышц животных, а также лейкозин пшеницы, ржи и ячменя, легуменин гречихи и сои, рицин касторовых бобов.
Альбумины выполняют в организме питательную, транспортную, обезвреживающую функции.
Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль.
Они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция.
Альбумины связывают токсичные соединения – алкалоиды, тяжелые металлы, билирубин.
Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в поддержании осмотического давления крови. Альбумины обеспечивают на 80% осмотическое давление крови от всех других сывороточных белков.
Альбумины синтезируются преимущественно в печени и быстро обновляются.
Глобулины
Глобулины – широко распространённая группа глобулярных белков, обычно сопутствующая альбуминам. Глобулины имеют более высокую молекулярную массу, чем альбумины. Глобулины слабокислые или нейтральные белки.
Глобулины растворимы в слабых солевых растворах, не растворимы в дистиллированной воде и выпадают в осадок при 50% и более насыщении растворов сернокислым аммонием, при нагревании свертываются.
К глобулинам относятся сывороточный, молочный, яичный, мышечный и другие глобулины.
Глобулинов много в пищевых продуктах. В горохе содержится белок легумин, в сое – глиципин, в семенах фасоли — фазеолин, в картофеле — туберин, в крови — фибриноген, в молоке — лактоглобулин, в яйцах — яичный глобулин, в конопле – эдестин.
Глобулины в организме выполняют питательную, защитную, транспортную функции.
В крови глобулины транспортируют холестерин, фосфолипиды, триглицериды, ионы железа (Fe2+), меди (Cu2+), витамин В12. В молоке лактоглобулины и лактальбумины также выполняют транспортную функцию.
Глобулины вырабатываются печенью и иммунной системой.
Протамины
Протамины – низкомолекулярные положительно заряженные ядерные белки с резко выраженными основными свойствами (щелочные белки), с низкой молекулярной массой – 4000–12000, содержат 60-85% аргинина.
Протамины являются составной частью многих важных сложных белков (нуклеопротеидов), входящих в состав клеточных ядер. В ядрах клеток они находятся в комплексе с ДНК.
Протамины хорошо растворяются в воде, кислой и нейтральной среде и осаждаются в щелочных средах, не осаждаются при кипячении.
Протамины обнаружены в ядрах сперматозоидов у рыб. Составляют фракцию основного белка в зрелой сперме рыб.
Протамины содержатся в сперме некоторых видов рыб (сальмин – семга, клупеин – сельдь), скумбрин – скумбрия.
Выполняют главным образом структурную функцию, поэтому и присутствуют в клетках не способных к делению.
Гистоны
Гистоны представляют собой низкомолекулярные (11000–22000) белки с третичной структурой, обладают выраженными основными (щелочными) свойствами, т.к. содержат большое количество аргинина и лизина.
Гистоны содержатся в ядрах клеток высших организмов в соединении с нуклеиновыми кислотами, образуя нуклеопротеиды.
Гистоны играют важную роль в регуляции генной активности. Это белки хромосом, они входят в структуру хроматина. В клетках положительно заряженные гистоны связаны с отрицательно заряженными ДНК в составе хроматина. Гистоны в хроматине формируют остов, на который накручивается молекула ДНК.
Это очень стабильные белки, молекулы которых могут сохраняться в течение всей жизни клетки.
Гистоны находятся в виде нуклеопротеидов в лейкоцитах и красных кровяных шариках (гемоглобин).
Гистоны по своим свойствам близки к протаминам, растворимы в воде и разбавленных кислотах, нерастворимы в водном аммиаке и не свертываются при нагревании. Молекулы гистонов полярны, очень гидрофильны, поэтому они с трудом высаливаются из растворов.
Основные функции гистонов – структурная и регуляторная.
Структурная – гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно хроматина, хромосом и нуклеосом.
Регуляторная – заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Проламины
Проламины – белки растительного происхождения, содержатся в клейковине семян злаковых растений, где выполняют роль запасных белков. В их состав входит большое количество глутаминовой кислоты и пролина (отсюда название проламин).
Проламины почти не содержат глицина и лизина, что делает невысокой их пищевую ценность.
Характерной особенностью проламинов является то, что они не растворимы в воде, солевых растворах, щелочах, хорошо растворимы в 60-80% растворе этилового спирта (это связано с наличием большого количества неполярной аминокислоты пролина), в то время как все другие белки денатурируют и выпадают в осадок.
К ним относятся глиадин (белок пшеницы, ржи), гордеин (белок ячменя), зеин (белок кукурузы), авенин (белокян овса), эдестин (белок конопли).
Проламины практически отсутствуют в бобовых и масличных культурах.
Глютелины
Глютелины – белки растительного происхождения, характеризующиеся высоким содержанием аминокислот пролина и глутаминовой кислоты.
Глютелины играют важную роль в питании человека, т. к. их питательная ценность высока. Они присутствуют в семенах злаковых культур вместе с проламинами.
Глютелины занимают промежуточное положение между проламинами и глобулинами.
Глютелины растворяются в разбавленных кислотах и щелочах, не растворяются в воде, спирте и разбавленных солевых растворах.
Представителями данного класса простых белков является оризенин (белок риса), глютелин (белок кукурузы) и глютенин (белок пшеницы).
У риса 80% всего белка приходится на глютелины (оризенин), этим можно объяснить высокое содержание лизина в белке рисового зерна.
Эти белки в ржаной муке не образуют клейковины, что обусловлено качественным различием белков ржи и пшеницы.
Протеиноиды
Протеиноиды – фибриллярные белки, их молекулы образуют многомолекулярные нитевидные комплексы – фибриллы.
Протеиноиды – белки животного происхождения, богаты глицином, пролином, цистином. Они могут иметь третичную и четвертичную структуры.
Протеиноиды – белки опорных тканей (костей, хрящей, сухожилий, связок). Они представлены коллагеном, эластином и кератином.
Протеиноиды не растворяются в воде, солевых растворах, разведенных кислотах и щелочах. Не перевариваются в желудочно-кишечном тракте большинства животных и человека и поэтому не могут выполнять питательную функцию. Однако, некоторые членистоногие приспособились к питанию фибриллярными белками кожи, перьев птиц, шерсти (например, моль).
К протеиноидам относятся коллаген – основной белок кожи, костей и хрящей, эластин – белок сухожилий и соединительной ткани, кератин – белок волос, шерсти, копыт, рогов и фиброин шелка.
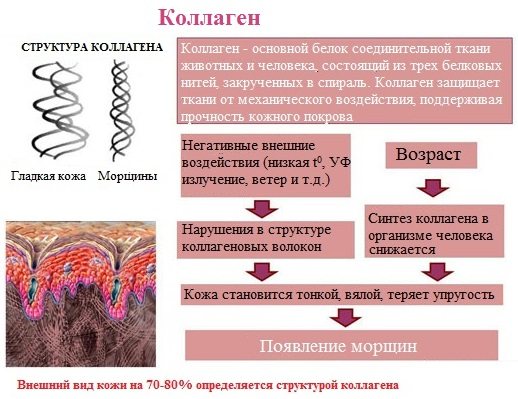
Коллаген
Коллаген – основной белок соединительной ткани животных и человека, состоящий из трех белковых нитей, закрученных в спираль. Коллаген защищает ткани от механических воздействий, поддерживая прочность кожного покрова.
Коллаген – широко распространённый в организме белок, составляет около трети всех белков организма. Более 80% всего коллагена организма находится в межклеточном веществе соединительной ткани кожи, костей, связок, сухожилий, хрящей. Эти ткани обладают малой растяжимостью и высокой прочностью.

К особенностям аминокислотного состава коллагена относится, прежде всего, высокое содержание глицина, пролина. Полипептидные цепи коллагена содержит около 1000 аминокислот.
Коллаген, долго нагреваемый в воде при 56-1000С, переходит в растворимый клей, или глютин (желатин), который охлаждаясь, застывает и образует студень. На этом свойстве желатина основано приготовление заливных блюд.
Эластин
Эластин – основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе таких тканей, как кожа, стенки кровеносных сосудов, связки, лёгкие. Эти ткани обладают очень важными свойствами: они могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв, и возвращаться в первоначальное состояние после снятия нагрузки.
Эластичность связана с присутствием в эластине большого количества межцепочечных сшивок при участии аминокислоты лизина.
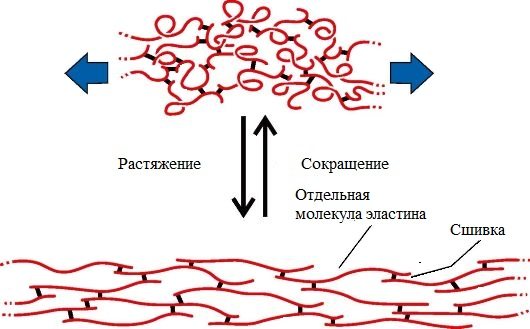
Эластин не растворим в воде, не способен к набуханию. В составе эластина содержится много гидрофобных аминокислот — глицина, валина, аланина, лейцина, пролина.
Кератин
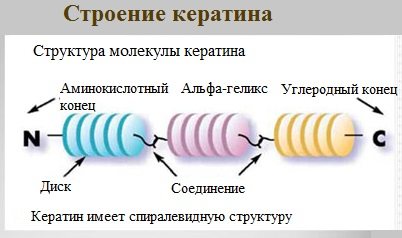
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину.
Волосы (шерсть), ногти, перья, иглы, когти, рога и копыта животных состоят главным образом из кератина.
Кератины могут иметь α-структуру и β-структуру.
α-Кератин — структурный белок, построенный преимущественно в виде α-спирали.
В α-кератинах три α-спирали объединяются в суперспираль. Молекулы α-кератина ориентированы параллельно и соединены дисульфидными связями (содержат много цистеина), что придает прочность структуре.
Примером β-кератинов является фиброин шелка.
Кератины не растворимы в растворах солей, кислот, щелочей. Их молекулярная масса очень высока.
Фиброин шелка
Фиброин шелка – фибриллярный белок, выделяемый паукообразными и некоторыми насекомыми и составляющий основу нитей паутины и коконов насекомых, в частности, шёлка тутового шелкопряда.
Его β-структура состоит из антипараллельных полипептидных цепей, связанных между собой водородными связями. Фиброин состоит в основном из глицина, аланина, серина, тирозина.
Сложные белки
Фосфопротеины
Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу.
К белкам этого класса относятся:
- казеин молока, в котором содержание фосфорной кислоты достигает 1%;
- вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца;
- овальбумин, открытый в белке куриного яйца;
- ихтулин, обнаруженный в икре рыб и, который играет немаловажную роль в развитии эмбриона рыб.
Биологическая роль фосфопротеинов заключается в том, что они являются питательными веществами необходимыми для растущих организмов.
Фосфопротеины – это ценный источник энергетического и пластического материала для развития зародыша и дальнейшего роста и развития организма.
Например, казеин (казеиноген) молока содержит все незаменимые аминокислоты и фосфорную кислоту. В его состав также входят ионы кальция.
Фосфор и кальций необходимы растущему организму в больших количествах для формирования скелета.
Гликопротеины
Гликопротеины (гликоконъюгаты) – это сложные белки, которые содержат в качестве простетической группы углеводный компонент.
У некоторых гликопротеидов углеводная часть непрочно связана с белком и может легко от него отделяться. Простетические группы некоторых гликопротеидов могут встречаться в тканях и в свободном состоянии.
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани. Многие ферменты и транспортные белки являются гликопротеинами.
Гликопротеины разделяют на истинные гликопротеины и протеогликаны.
Истинные гликопротеины
Углеводная часть гликопротеинов представлена небольшими гетерополисахаридами или олигосахаридами нерегулярного строения и содержит маннозу, галактозу, глюкозу, и их аминопроизводные. Белок в них составляет 80-85% массы макромолекулы.
Для гликопротеинов характерна ковалентная гликозидная связь. N-гликозидная связь возникает между углеводным компонентом и амидной группой аспарагина в белках. Например, в иммуноглобулинах, ферментах и гормонах).
О-гликозидная связь – моносахарид связан с ОН-группой серина или треонина (в муцинах), а иногда с ОН-группой гидроксилизина или гидроксипролина (коллагены).
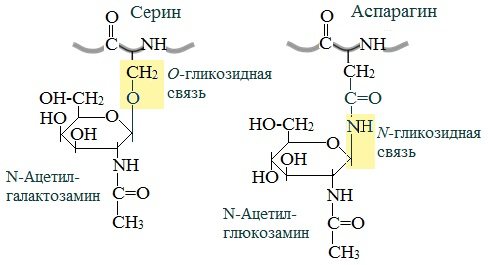
К типичным гликопротеинам относят большинство белковых гормонов, секретируемые в жидкие среды организма вещества, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, интерфероны, группы крови.
Функциии гликопротеинов
- Структурная – коллаген, эластин.
- Защитная – антитела (иммуноглобулины), интерферон, факторы свертывания крови (протромбин, фибриноген).
- Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ.
- Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны.
- Ферментативная – ферменты: холинэстераза, нуклеаза.
- Транспортная – перенос веществ в крови и через мембраны (трансферрин, транскортин, альбумин, Na+,К+-АТФаза).
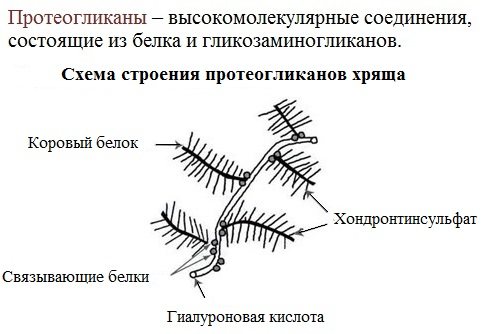
Протеогликаны
Особую группу гликопротеинов составляют протеогликаны, в составе которых углеводный компонент преобладает и на его долю приходится от 90% и выше. Более того, эти вещества по своим свойствам более сходны с полисахаридами, чем с белками.
Простетическая группа протеогликанов представлена гетерополисахаридами, имеющими регулярное строение.
Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина.
Углеводные фрагменты усиливают гидрофильные свойства белка за счёт большого количества ОН-групп и кислотных группировок. Цепи последних недостаточно гибкие и стремятся принять конформацию очень рыхлого случайного клубка, занимая огромный объём.
Будучи гидрофильными, они притягивают много воды и даже в низких концентрациях образуют гидратированные гели. Подобная способность создаёт во внеклеточном пространстве – тургор.
Протеогликаны образуют основное вещество межклеточного матрикса (межклеточного пространства).
Протеогликаны хрящевого матрикса содержат гиалуроновую кислоту, образующую студенистый гель, выполняющий роль амортизатора в хрящах и суставных поверхностях.
По функции протеогликаны значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. Они имеют древовидную структуру, в центре находится гиалуроновая кислота.
Т.к. их молекулы гидрофильны, они создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов.
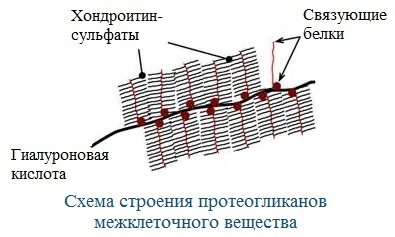
В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные – например агрекан и ворсикан.
В межклеточном пространстве имеется также целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там разнообразные функции.
По соотношению белковой и углеводной частей гликопротеины подразделяются на нейтральные и кислые.
К нейтральным гликопротеинам относятся яичный белок (овальбумин), гликопротеины плазмы крови, белок щитовидной железы (тиреоглобулин).
К кислым гликопротеинам относятся – муцины и мукоиды.
Муцины являются основой слизей организма (слюны, желудочного и кишечного сока). Выполняют защитную функцию — предохраняют стенки пищеварительного тракта от механических, химических повреждений. Муцины устойчивы к действию ферментов, которые гидролизуют белок.
Мукоиды – это белки синовиальной жидкости суставов, хрящей, жидкости глазного яблока. Выполняют защитную функцию, являются смазочным материалом в аппарате движения.
В состав кислых гликопротеинов входит уроновая кислота, которая принимает участие в обезвреживании билирубина и лекарственных средств.
Нуклеопротеины
Нуклеопротеины (ДНП и РНП) – это сложные белки, простетической группой которых являются нуклеиновые кислоты (РНК и ДНК).
В природе обнаружено 2 типа нуклеопротеинов – дезоксирибонуклеопротеины (ДНП) – комплексы белков с дезоксирибонуклеиновой кислотой (ДНК) и рибонуклеопротеиды (РНП) – комплексы белков с рибонуклеиновой кислотой (РНК).
ДНП преимущественно локализованы в ядре, митохондриях, а РНП – в цитоплазме, а в ядре (ядрышке) обнаружены также высокомолекулярные РНП.
Выделяют два вида нуклеиновых кислот в зависимости от пентозы, входящей в их состав – рибонуклеиновая кислота (РНК), если в ее состав входит рибоза и дезоксирибонуклеиновая кислота (ДНК), если в ее состав входит дезоксирибоза.
Отличия между РНК и ДНК
- количество цепей: в РНК одна цепь, в ДНК две цепи;
- размеры: ДНК намного крупнее;
- локализация в клетке: ДНК находится в ядре, почти все РНК – вне ядра;
- вид моносахарида: в ДНК – дезоксирибоза, в РНК – рибоза;
- азотистые основания: в ДНК имеется тимин, в РНК – урацил;
- функция: ДНК отвечает за хранение наследственной информации, РНК – за ее реализацию.
ДНК преимущественно сосредоточена в ядре клеток в составе хромосом, митохондриях и хлоропластах.
Функции ДНК
Хранение, воспроизводство и передача по наследству генетического материала, экспрессия генов.
Различают три главных вида РНК:
- матричная (информационная) – мРНК (иРНК) содержится в ядре и цитоплазме.
- транспортная – тРНК в основном содержится в цитоплазме клетки.
- рибосомная – рРНК составляет существенную часть рибосомы.
Функции РНК
мРНК (иРНК) – считывает информацию с участка ДНК о первичной структуре белка и несет эту информацию к рибосомам (несет информацию из ядра в цитоплазму).
тРНК – транспортирует аминокислоты к месту синтеза белка (из цитоплазмы к рибосомам).
рРНК – входит в состав рибосом (из нее построен каркас рибосом), участвует в синтезе белковой (полипептидной) цепи.
РНК в некоторых вирусах является носителем генетической информации вместо ДНК.
Видеофильм «Нуклеиновые кислоты в биосинтезе белка»
Липопротеины
Липопротеины – сложные белки, простетическая группа которых представлена каким-либо липидом.
Липиды играют важную роль в организме человека. Они содержатся во всех клетках и тканях и участвуют во многих обменных процессах.
Они составляют структурную основу всех биологических мембран, в свободном состоянии присутствуют в основном в плазме крови и лимфе.
Липопротеины плазмы, сыворотки крови растворимы в воде. Липопротеины мембранных стенок клеток, нервных волокон нерастворимы в воде.
В состав липопротеинов могут одновременно входить свободные триглицериды, жирные кислоты, нейтральные жиры, фосфолипиды и холестерин (холестерол).
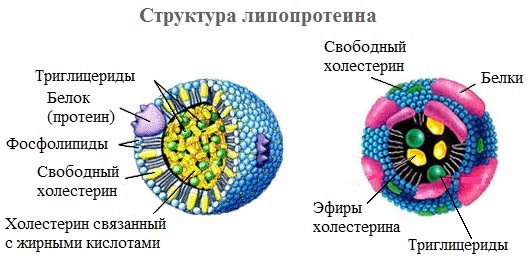
Все типы липопротеинов имеют сходное строение: гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками (апопротеинами), фосфолипидами и холестеролом. Триацилглицеролы (ТАГ) и эфиры холестерола составляют гидрофобное ядро.
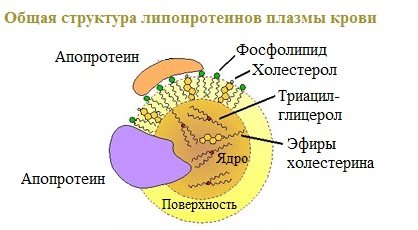
Гидрофильные группы этих молекул ориентированы в водную фазу, а гидрофобные части – к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.
Липиды не растворяются в воде, потому не могут переноситься кровью в чистом виде. Поэтому для транспорта липидов кровью в организме образуются комплексы липидов с белками – липопротеины.
В организме синтезируются следующие типы липопротеинов: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).
Каждый из типов ЛП образуется в разных тканях и транспортирует определенные липиды.
Общая функция всех липопротеинов – это транспорт липидов.
Липопротеины хорошо растворимы в крови, так как имеют небольшой размер и отрицательный заряд на поверхности. Некоторые липопротеины легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам.
Большой размер хиломикронов не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой.
Липопротеины очень низкой и низкой плотности вызывают при повышении их концентрации в крови атеросклероз.
При нарушениях транспорта липидов и липидного обмена снижается энергетический потенциал организма, ухудшается передача нервных импульсов, снижается скорость ферментивных реакций. Без участия липопротеинов невозможен транспорт жирорастворимых витаминов: витаминов групп А, Е, К, D.
Хромопротеины
Хромопротеины («цветные белки») – сложные белки, содержащие в качестве простетической группы окрашенный компонент.
Хромопротеины участвуют в таких процессах жизнедеятельности, как фотосинтез, дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
В зависимости от их строения различают гемопротеины, флавопротеины, родопсин.
Гемопротеины (красные) – сложные белки, простетической группой которых служит гем.
К группе гемопротеинов относятся гемоглобин, миоглобин, хлорофиллсодержащие белки и ферменты (цитохромы, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента железо- (или магний) порфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции.
Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). Гемопротеины (железопорфирины), напротив, катализируют обратную реакцию — образование молекулы воды, связанное с освобождением энергии.
Гемоглобин – главный компонент эритроцита и основной дыхательный пигмент, обеспечивает перенос кислорода (О2) из легких в ткани и углекислого газа (СО2) из тканей в легкие. Поддерживает кислотно-основное равновесие крови.
У гемоглобина белковый компонент представлен глобином, а небелковым компонентом является гем – пигмент. Ион железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Гем представлен порфирином, состоящим из 4-х пиррольных колец. Каждая из 4 молекул гема «обернута» одной полипептидной цепью.
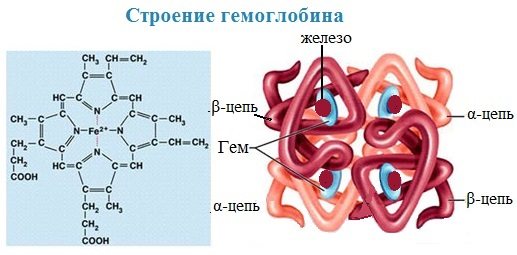
Гем является простетической группой и у миоглобина, каталазы, пероксидазы, цитохромов. Гем встречается также в растительных гемопротеинах и участвует в процессе фотосинтеза.
Миоглобин (белок мышц) – небольшой глобулярный белок, молекула его состоит из одной полипептидной цепи и одного гема. Миоглобин создает в мышцах резерв кислорода, используемый мышечными волокнами.
К хромопротеинам относятся и флавопротеиды, простетическими группами у которых являются изоаллоксазиновые производные. Флавопротеиды входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке. В некоторые флавоноиды включены ионы металлов и молекула гема.
Родопсин – это белок, простетической группой которого служит активная форма витамина А – ретиналь. Родопсин — основное светочувствительное вещество палочек сетчатки глаза. Его функция состоит в восприятии света в сумерках, т.е. отвечает за сумеречное зрение.
Металлопротеины
Металлопротеины – сложные белки, где роль небелкового компонента выполняют ионы металлов.
К числу металлопротеинов относятся около сотни ферментов.
Важная функция металлопротеинов связана с транспортированием металлов и их хранением в организме.
Типичными металлопротеинами являются белки, содержащие негемовое железо – трансферрин, ферритин, гемосидерин, имеющие важное значение в обмене железа в организме.
Трансферрин – растворимый в воде железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит два иона Fe3+. Этот белок служит переносчиком железа в организме. Трансферрин синтезируется в печени.
Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме.
Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови.
Церулоплазмин – сывороточный белок, содержащий медь и принимающий участие в ее метаболизме, а также обменных процессах железа. Относится к α-2-глобулинам.

Каталаза — обезвреживает перекись водорода.
Цитохромоксидаза — в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ.
Алкогольдегидрогеназа — обеспечивает метаболизм этанола и других спиртов
Лактатдегидрогеназа — участвует в метаболизме молочной кислоты
Карбоангидраза — образует угольную кислоту из CO2 и H2O.
Ксантиноксидаза — отвечает за последние реакции катаболизма пуриновых оснований.
Тиреопероксидаза — участвует в синтезе гормонов щитовидной железы.
Глутатионпероксидаза — антиоксидантный фермент.
Уреаза — отвечает за распад мочевины.
2.По форме молекул (фибриллярные и глобулярные)
Белки можно классифицировать по форме молекул и некоторым физически свойствам на два больших класса: фибриллярные и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
Наиболее важна вторичная структура (третичная почти совсем не выражена).
Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу.
Эти белки отличаются высокой механической прочностью, выполняют структурную функцию.
К фибриллярным белкам относятся кератины (волосы, шерсть, рога, копыта, ногти, перья), миозин (мышцы), коллаген (сухожилия и хрящи), фиброин (шелк, паутина).
Глобулярные белки характеризуются компактной трехмерной укладкой полипептидных цепей, их молекулы имеют форму глобулы.
Наиболее важна третичная структура.
Глобулярные белки растворяются в воде или в разбавленных солевых растворах. Из-за большого размера молекул эти растворы – коллоидные.
Глобулярные белки выполняют функции ферментов, антител (глобулины сыворотки крови определяют иммунологическую активность) и в некоторых случаев гормонов (инсулин).
Они играют важную роль в протоплазме, удерживая в ней воду и некоторые другие вещества, способствуют поддержанию молекулярной организации.
Глобулярные белки встречаются в физиологических жидкостях (сыворотке крови, молоке, пищеварительных жидкостях), в тканях организма.
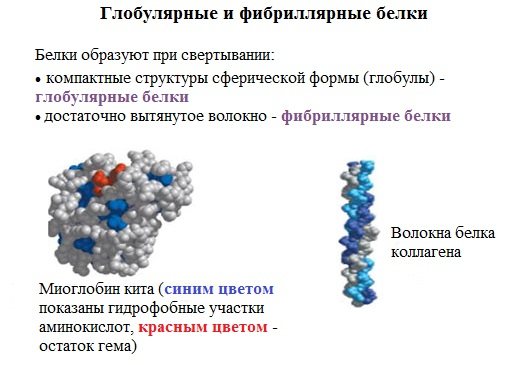
Существуют также и промежуточные белки фибриллярной природы, но растворимые. Примером служит фибриноген, превращающийся в нерастворимый фибрин при свертывании крови.
3.По растворимости в отдельных растворителях
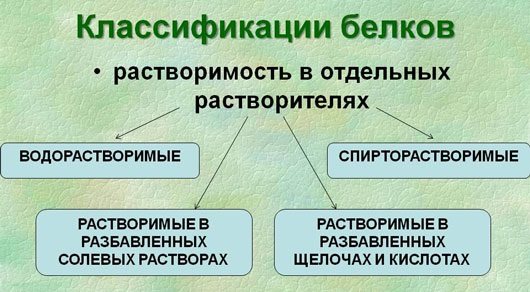
Классификация простых белков основана преимущественно на растворимости в воде, спирте, солевых растворах, растворах щелочей и кислот.
4.По аминокислотному составу
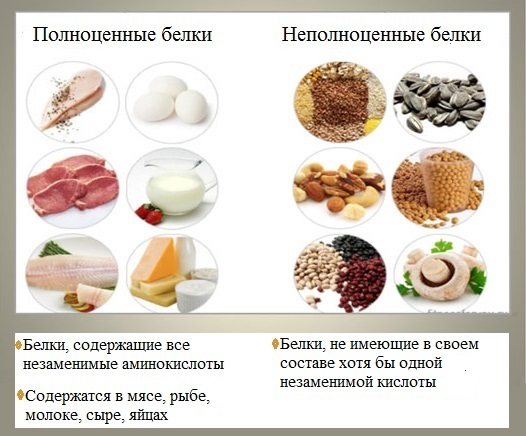
С точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием незаменимых аминокислот, белки подразделяются на полноценные и неполноценные.
Полноценными считаются белки, включающие в состав восемь незаменимых аминокислот, которые самостоятельно организм синтезировать не может.
Неполноценными считаются белки, которые содержат недостаточное количество одной или нескольких незаменимых аминокислот, которые не могут быть синтезированы организмом.
Полноценные белки содержатся в продуктах животного происхождения (кроме желатина), а также некоторой растительной пище (горох, фасоль, соя).
Неполноценные белки – преимущественно растительного происхождения.
Белки
Использование белков, углеводов и жиров в рационе
Если подходить к питанию с точки зрения науки, то человеку требуются не конкретные продукты питания, а их элементы для роста и жизнедеятельности организма. Это 3 группы веществ: белки, жиры, углеводы. Все они должны присутствовать в конкретном количестве каждый день, в противном случае возможны сбои в организме и ухудшение здоровья. Также имеется некоторое соотношение между этими веществами, которого необходимо придерживаться.
Диетологи рекомендуют строить свой рацион, учитывая следующую норму: 15% белков, 20% жиров и 65% углеводов. Конечно, это средняя пропорция: она зависит от конкретного организма, параметров роста, веса и возраста человека. Поэтому субъективные цифры следует определять, обратившись к диетологу или тренеру.
Особенности белкового питания для роста мышц
При любых интенсивных видах спорта важным значением является увеличение мышечной массы тела, повышение выносливости организма. Это достигается усиленными тренировками и особым питанием, при котором употребляются продукты с высоким содержанием белка.
Лучше всего будет, если меню белкового питания будет составлять врач или тренер спортсмена. Важно правильно рассчитать белковый рацион, количество калорий, углеводов и жиров.
В белковый рацион спортсмена должны входить: обезжиренные молочные продукты, постное мясо, отварной яичный белок, нежирная морская рыба. Питание должно быть дробным – 5 раз в день. После интенсивной тренировки рекомендуется принимать протеиновый коктейль.
В период набора мышечной массы процентное соотношение биологических веществ следующее: 70 % – белка, 30 % – жиры и углеводы. Максимальная продолжительность белковой диеты должна быть не более 1 месяца. Дольше этого времени ее применение может нанести вред организму.
Работа протеинов
Высокомолекулярные биологические соединения, к чему относятся белки, расщепляются до аминокислот, которые проникают в кровь и насыщают организм, а он применяет их для строительства своих протеинов. Чтобы тело приобрело крепкие мускулы и красивый подтянутый вид, необходимо пополнять рацион белками. Их достаточно в рыбе и мясе, яйцах и сыре, бобовых и соевых продуктах. Рассчитывать рацион следует исходя из дневной нормы всех ингредиентов, а также из поставленных целей.

Тем, кто желает подкачать мышцы, стоит повысить прием белков, а худеющим следует снизить употребление высокоуглеводной и жирной пищи. Белки, жиры, углеводы относятся к главным источникам энергии и силы. В среднем, человеку для здорового питания и поддержания нормального веса, необходимо принимать с едой белки, жиры, углеводы в такой пропорции: 90-110/90-100/250-300 г. Для детей эти цифры немного меньше.
Белковые продукты и ежедневная порция:
- курица, индейка, постная ветчина — 75 г;
- свинина, баранина, говядина — 45 г;
- жирная рыба – 30 г; постная рыба, морепродукты – 60 г;
- фасоль, чечевица – 2 ст. л.;
- бекон — 1 постный ломтик;
- рыбные палочки – 2 шт.;
- хумус пониженной жирности – 1 ст. л.;
- яйца — 1 шт.;
- орехи — 15 г.
Мышцы строятся из белка, а пища человека должна обязательно содержать его, ведь он источник силы. Белки рыбы и птицы усваиваются лучше всего. Такие продукты, как бобовые, крупы, и соя тоже содержат белки, и притом незначительное количество жира, от них не отстают сыры и кисломолочные продукты.
Функции белков в организме
1. Пластическая (структурная) функция.Из белков строятся все ткани и органы человека, они придают форму клетке и её составным частям.
2. Гормональная и ферментативная функция. Белки являются основой всех ферментов (катализаторов), без которых невозможны усвоение пищи и все биохимические реакции в организме.
Белки-гормоны регулируют концентрацию веществ в крови и клетках, рост, размножение и многие другие процессы. Например, белок инсулин регулирует концентрацию сахара в крови и отправляет сахар в мышцы или печень.
3. Защитная функция. Белок коллаген создает основу кожного покрова, который защищает организм от окружающей среды; белки-ферменты расщепляют токсины в печени; белки крови составляют основу иммунной системы организма и защищают от вирусов, бактерий и чужеродных белков.
4. Транспортная функция. Белки обеспечивают транспорт различных минеральных солей и витаминов через мембраны клеток и внутриклеточных структур, участвуют в переносе кислорода, липидов, углеводов, некоторых витаминов, гормонов и лекарственных средств.
5. Распределительная функция. Белки участвуют в распределении жидкости между внутри- и внеклеточной средой в организме.
6. Энергетическая функция. При потреблении большего количества белка, чем необходимо для тканей и клеток организма, человеческое тело использует его в качестве энергетического ресурса. Эта функция включается при недостатке других источников энергии – углеводов и жиров.
7. Двигательная функция. Белки актин и миозин обеспечивают движение мышц.
Интересное о белках
Свыше 4 миллиарда лет назад на планете Земля из незначительных неорганических молекул невероятным образом появились белки, которые стали зарождением жизни. Все живое существует благодаря уникальным молекулам белка, и другие формы жизни во Вселенной ученым пока неизвестны.
- Каждый живой организм создан из белков. Они занимают около 50% сухого вещества любого из организмов. Вирусы содержат протеина от 45 до 95%.
- Примерно 30% протеина человека приходит на мускулы, около 20% — на кости и сухожилия, и около 10% — на кожу.
- Насчитывается 1012 разных белковых веществ, дающие жизнь организмам всех ступеней сложности, от вирусов к людям.
- Мозг – это тоже протеин. Следует помнить, что вследствие процесса денатурации белка при попадании в организм этилового спирта, отмирают клетки мозга.
- Своим наименованием белки обязаны белку яйца, именно его с древних пор употребляли люди как составляющую еды.
- Роль белков в организме самая разнообразная, они могут выступать в роли ферментов. Пепсин — фермент, расщепляющий белки до аминокислот в организме.
- Протеины обладают защитным действием. Интерферон – это протеин, спасающий человеческий организм от вторжения вирусов.
- Белки могут играть роль гормонов, примером служит гормон инсулин. Он содействует поступлению глюкозы в клетку.
- Протеины реализовывают энергетическую задачу для организма.
- Волосы состоят из чистого белка.
Что такое белок
Белок – это сложное органическое соединение, которое состоит из аминокислот. В белке их может быть от сотни до тысячи. Именно разнообразие этих маленьких кирпичиков определяет, что это будет за белок и на сколько, будет здоровым наше тело.
Аминокислот всего – 20. По аналогии с книгой, у нас всего 33 буквы алфавита, а какой красноречивый наш язык. Правда? Незаменимых аминокислот – 8, получить их можно только из пищи, и 2 условно заменимые. Если представить визуально, это вся палитра белковых продуктов, которые мы знаем.
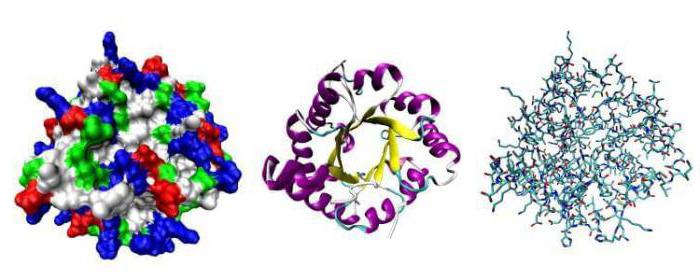
Структуры белка
Существуют 4 пространственных организации белковых молекул:
- первичная — создана пептидными связями, именно она определяет свойства молекул белка;
- вторичная, имеющая форму растянутой пружины, построена из пептидных и водородных связей (сухожилия, ногти, волосы, паутина);
- третичная, имеющая форму шара, построена из пептидных, водородных и дисульфидных связей (ферменты, антитела, гормоны);
- четвертичная — состоит из альфа- и бета-цепочек (гемоглобин).
Каждому белку присвоен генетический код, где хранится информация о том, какую форму он должен принять, но генетики и сейчас не умеют предугадывать по первичному коду его пространственную структуру. Для работы белка, ему необходимо свернуться определенным образом.
Очень важно знать, какие продукты питания содержат белок, какой он и сколько его необходимо употреблять. Почему? А потому, что белок, сгорая в организме, насыщает его большим количеством энергии. Именно после высокобелковой пищи, мы чувствуем прилив сил, именно белок выстраивает каждый наш мускул и творит красивое и здоровое тело. Не менее важным считается тот факт, что белок помогает похудеть или удержать вес после похудения.
Список продуктов, содержащих белок
| Продукт питания | Белки (г.) в 100 г продукта |
| Морепродукты | |
| Икра красная | 31,6 |
| Горбуша | 23 |
| Лосось | 20 |
| Палтус | 20 |
| Креветки | 18,7 |
| Окунь | 18,5 |
| Сайра в масле | 18,4 |
| Сельдь | 18 |
| Кальмар | 18 |
| Навага, треска | 17,8 |
| Минтай | 17,7 |
| Камбала | 17,5 |
| Шпроты (консервы) | 17,3 |
| Осетр | 15,8 |
| Мясные продукты | |
| Курица отварная | 25 |
| Куриная грудка | 23 |
| Куриная печень | 22 |
| Курица | 20,5 |
| Говядина | 21 |
| Говядина | 21 |
| Свинина | 20,5 |
| Печень свиная | 20,2 |
| Баранина | 20 |
| Печень говяжья | 19,8 |
| Говядина тушёная | 16,7 |
| Свинина тушёная | 15 |
| Яйца | |
| Яйцо куриное | 12,9 |
| Яйцо перепелиное | 11,9 |
| Молочные продукты | |
| Сыр пармезан | 35 |
| Сыр голландский | 26 |
| Молоко сухое цельное | 25 |
| Сыр российский | 23 |
| Творог нежирный | 18 |
| Творог жирный | 14 |
| Сыр плавленый | 12 |
| Молоко сгущённое с сахаром | 7,2 |
| Йогурт | 3-4,5 |
| Кефир | 3,3 |
| Молоко цельное | 3,3 |
| Молоко пастеризованное | 3 |
| Сметана 10% жирности | 3 |
| Сливки 10% жирности | 3 |
| Сливки 20% жирности | 2,8 |
| Сметана 20% жирности | 2,8 |
| Орехи и бобовые | |
| Соевая мука | 37 |
| Соя | 36 |
| Арахис | 26,2 |
| Тыквенные семечки | 24 |
| Чечевица | 23,5 |
| Семена подсолнечника | 22,5 |
| Фасоль | 21 |
| Горох | 21 |
| Фисташки | 20 |
| Нут | 20 |
| Миндаль | 18,8 |
| Кешью | 18,5 |
| Грецкий орех | 16,2 |
| Фундук | 15 |
| Бразильский орех | 14,3 |
| Кедровый орех | 13,8 |
| Пекан | 9,2 |
| Зерновые | |
| Пшеничные отруби | 15 |
| Овсяная мука | 14 |
| Геркулес | 13 |
| Кускус | 13 |
| Гречневая крупа | 12,5 |
| Пшеничная крупа | 12,5 |
| Булгур | 12 |
| Пшено | 12 |
| Овсяная крупа | 12 |
| Манная крупа | 11 |
| Гречневая мука | 11 |
| Мука пшеничная 1 сорта | 10,6 |
| Мука пшеничная высшего сорта | 10 |
| Ячневая крупа | 10 |
| Перловая крупа | 9 |
| Кукуруза (цельные зерна) | 8,5 |
| Кукурузная мука | 8 |
| Хлеб ржаной зерновой | 8,5 |
| Пшеничный хлеб (белый) | 7,6 |
| Рис бурый | 7,5 |
| Рис белый | 7 |
| Рис белый отварной | 2 |
| Овощи | |
| Горошек зеленый | 5 |
| Капуста брюссельская | 4,5 |
| Кресс-салат | 4,2 |
| Брокколи | 3 |
| Шпинат | 2,8 |
| Капуста цветная | 2,5 |
Продукты, относящиеся к белкам
Недаром белковые диеты признаны самыми результативными среди диетологов, ведь организм тратит на переработку белковой пищи много энергии, около 5-10% поступивших калорий.
Список самых белковых продуктов.
- В куриных яйцах содержится 17% легкоусвояемого протеина. Диетологи советуют принимать в пищу яйца после физических нагрузок, но не более 2 штук в день для возобновления ткани мышц. При этом яйца — это продукт с низкой калорийностью.
- Творог обезжиренный содержит 25% белка, он легко усваивается.
- Твердый сыр имеет около 30% белка, но следует помнить, что он слишком калорийный, и чем он жирнее, тем меньше в нем содержится протеина.
- Мясо птицы — основной источник диетического питания, так как калорийность его небольшая и отлично усваивается. Мясо птицы содержит от 15 до 20% белка.
- Говядина низкокалорийный продукт и щедрый на белок. Всего одна порция нежирной говядины содержит около 22 г белка.
- Печенка состоит из 25% белка. В отварном и тушеном виде очень полезна, так как она богата другими необходимыми элементами.
- Некоторые сорта рыбы содержат белка до 25%, например, тунец, лосось, скумбрия. Такую рыбу можно использовать в пищу без боязни поправиться.
- Самым богатым на белок продуктом из растений считается соя, в ней содержится протеина 14%, из овощных лидеров — брюссельская капуста (9%).
- Крупы содержат не менее 10% белка, который превосходно усваивается организмом.

Это основные продукты, относящиеся к белкам. Список, который здесь приведен, далеко не полный, но учитывает основные потребности организма в белке.
Полезные советы
- Не злоупотреблять жирными сортами рыбы и мяса. Высокое содержание жира в ряде продуктов (грудинка говядины, свинина, семга, утка, печень трески, гусь) затрудняет пищеварение, а также мешает усвоению белка.
- Отказаться от мясных продуктов длительного хранения (сосиски, ветчина, сардельки, колбаса) и полуфабрикатов. Частое употребление мясных полуфабрикатов – это, возможно, самая большая проблема, которая способствует развитию белкового голодания. Общеизвестно, что в этих продуктах содержится мало чистого мяса, и в существующем состоянии оно почти не усваивается организмом.
- Оптимальными источниками белка являются яйца, нежирная говядина, нежирная птица. Растительные белки (орехи, гречка, горох, фасоль) также должны постоянно присутствовать в рационе.
- Кушать рыбу и мясо отдельно от хлеба, картофеля и каш. Лучшим дополнением к белковой пище является салат из овощей (свекла, морковь, капуста).
- Самый полезный для организма способ приготовления мяса – шашлык или гриль. Таким образом, происходит удаление из организма большого количество жира, перегружающего ЖКТ.
- Полезнее всего есть белковую пищу на ужин, так как за ночь организм полностью успевает ее усвоить.
Однако во всем следует придерживаться золотой середины, для чего нужен контроль за питанием.
Чрезмерное употребление пищи, содержащей много белка, приводит к увеличению нагрузки на печень и почки, перегрузке пищеварительной системы.
Физико-химические свойства
Молекулы Б. имеют массу от нескольких тысяч до 1 миллиона и выше. Константа седиментации варьирует от 1 до 20 и более. Средний удельный объём белковых молекул 0,70–0,75 см3/г. Молекулы Б. обладают слабой способностью к диффузии и не проходят через полупроницаемые мембраны. Максимум поглощения Б. в УФ-области спектра, обусловленный наличием в их молекулах ароматич. аминокислотных остатков, находится вблизи 280 нм. В ИК-области спектра Б. поглощают за счёт $\ce{COO}$- и $\ce{NH}$-групп при 1600 и 3100–3300 см–1. Растворимые Б. – гидрофильные коллоиды, активно связывающие воду. Б. – амфотерные электролиты, т. к. имеют свободные карбоксильные и аминные группы. Изоэлектрические точки у разных Б. колеблются от менее 1,0 (у пепсина) до 10,6 (у цитохрома c) и выше. Растворимость Б. также может существенно различаться. Одни Б. легко растворяются в воде, другим для растворения требуется наличие небольших концентраций солей, третьи переходят в раствор только под действием сильных щелочей или детергентов. Разные Б. неодинаково осаждаются из растворов органическими веществами (напр., спиртами) или высокими концентрациями солей (высаливаются). Существенные различия в растворимости и др. особенности используются при выделении индивидуальных Б. Белки дают ряд цветных реакций, обусловленных наличием определённых аминокислотных остатков или химических группировок. К важнейшим из них относятся биуретовая (реакция с биуретом, на пептидную связь) и нингидриновая (с нингидрином, на аминогруппу) реакции. Боковые группы аминокислотных остатков способны вступать во многие химические реакции. При этом реакционная способность одних и тех же группировок существенным образом зависит от положения в полипептидной цепи Б.: как от локализации группировки в общей пространственной структуре Б., так и от влияния соседних боковых групп. Наивысшей реакционной способностью обычно обладают группировки, расположенные в составе активного центра белка.
Получение белков
Разработаны методы выделения индивидуальных Б., основанные гл. обр. на хроматографии, включая аффинную, эксклюзионную, ионообменную и гидрофобную. Особенно продуктивно их применение в режиме высокоэффективной жидкостной хроматографии. Широко используются также ультрафильтрация, электрофорез и др. Критериями чистоты Б. являются гомогенность при электрофорезе, хроматографии и ультрацентрифугировании. У Б., состоящего из одной полипептидной цепи, она устанавливается при анализе N-концевой аминокислоты.
Для получения пептидов, в т. ч. гормонов и их разнообразных аналогов, а также пептидов, несущих антигенные детерминанты разл. Б. и используемых для приготовления соответствующих вакцин, широко применяется химич. синтез. Осуществлён химич. синтез некоторых небольших Б., однако эта очень трудоёмкая процедура до сих пор имеет скорее теоретическое, чем практическое значение. Б., имеющие пром. значение (ферменты, гормоны, цитокины, интерфероны), синтезируются с помощью технологии рекомбинантных ДНК (генетической инженерии) в чужеродных организмах и являются продуктами биотехнологич. производств. Методы белковой инженерии позволяют целенаправленно изменять структуру белков.